คืนค่าการตั้งค่าทั้งหมด
คุณแน่ใจว่าต้องการคืนค่าการตั้งค่าทั้งหมด ?
ลำดับตอนที่ #35 : [Finalเทอม2] เอาใจเด็กวิทย์ วิชา เคมี by.เพื่อนน้ำใจงาม
บอกไว้ก่อนนะคะว่าอิฉันไม่ใช่คนทำสรุปเคมีนี้แน่นอนร้อยเปอร์ มีคนInbox มาให้น่ะค่ะ
ขอขอบคุณอีกครั้ง ที่ส่งมาให้เราแชร์นะคะ //ปรบมือให้นางด้วยค่ะ
แก๊ส
สมบัติทั่วไป
แก๊ส เป็นสถานะหนึ่งของสาร ที่โมเลกุลลอยละล่องไปมา แทบไม่มีแรงยึดเหนี่ยวกับโมเลกุลข้างเคียง
สิ่งที่ต้องรู้เกี่ยวกับแก๊ส
- แก๊ส มีปริมาตรไม่คงที่ ขึ้นกับภาชนะที่บรรจุ
- แก๊ส มีรูปร่างไม่คงที่ ขึ้นกับภาชนะที่บรรจุ
1. บอยล์ ใช้เมื่ออุณหภูมิและโมลคงที่
P1V1 = P2V2
2.ชาร์ล ใช้เมื่อความดันและโมลคงที่
V1 = V2
T1 T2
3.กฏรวมของแก๊ส ใช้เมื่อโมลคงที่
T1 T2
4.สมการแก๊สอุดมคติ *ใช้แทนสามตัวบนได้
PV=nRT
หรือถ้ามีสองสภาวะ สำหรับคนที่ชอบจำไปเลย
P1V1 = P2V2
T1n1 T2n2
5.กฏการแพร่ของเกรแฮมม์
Ra = sqrt(Mb)
Rb sqrt(Ma)
6.กฏความดันย่อยของแก๊ส
ความดันรวมของระบบ = ผลรวมความดันย่อย
Pรวม = ผลรวม P ย่อย
แก๊สจริงและแก๊สอุดมคติ
__________________________________________________________________
| | แก๊สจริง | แก๊สอุดมคติ |
|_______________________|____________________|____________________|
| ขนาด(ปริมาตร)โมเลกุล | มี | ไม่มี (เป็นเสมือนจุด ) |
|_______________________|____________________|____________________|
| แรงยึดเหนี่ยวระหว่างโมเลกุล | มี | ไม่มี |
|_______________________|____________________|____________________|
เน้นพิเศษเก็งข้อสอบ(อ.บอกออกเกือบทุกปี)
Q:ทำอย่างไร แก๊สจริงจึงจะประพฤติตัวเข้าใกล้แก๊สอุดมคติ
A: ให้ลดความดัน เพิ่มอุณหภูมิ
Q:แก๊สชนิดใดประพฤติตัวคล้ายแก๊สอุดมคติ
A: แก๊สเฉื่อย (มีแรงระหว่างโมเลกุลต่ำมาก)
ทฤษฎีจลน์ของแก๊ส
หลักสำคัญๆ คือ
1.ในทฤษฎีจลน์ของแก๊ส อนุภาคแก๊สเป็นอนุภาคแก๊สอุดมคติ
2.โมเลกุลแก๊สเคลื่อนที่เป็นแนวเส้นตรงด้วยความเร็วคงที่
ถ้ามีการชน จะเป็นแบบยืดหยุ่นสมบูรณ์ (อนุภาคกระเด้งออกด้วยอัตราเร็วเท่าเดิม)
3.ที่อุณหภูมิเดียวกัน แก๊สทุกชนิดมีพลังงานจลน์เฉลี่ยเท่ากัน
เมื่ออนุภาคชนผนังก็จะเกิดแรงดล ทำให้ผนังภาชนะมีความดัน
โดยความดัน P แปรผันตาม F x f (ความถี่คูณความแรง)
F คือแรงดล คือ การดล/เวลา = mv/t
ดังนั้นปัจจัยที่มีผลต่อ ความแรงในการชน คือ มวล และ ความเร็ว
f คือความถี่ของการชน
ดังนั้นปัจจัยที่มีผลต่อความถี่ในการชน คือ ความเร็ว จำนวนโมล และ ปริมาตร
อุณหภูมิจะส่งผลโดยตรงต่อพลังงานจลน์ ดังนั้น ซึ่งจะส่งผลต่อความเร็ว
ปริมาตร - ส่งผลต่อ ความถี่
โดย ปริมาตร แปรผกผันกับกับความถี่
จำนวนโมล - ส่งผลต่อ ความถี่
โดย จำนวนโมล (คือจำนวนอนุภาค) แปรผันตรงกับความถี่
อุณหภูมิ - ส่งผลต่อความถี่ และ ความแรง
โดย อุณหภูมิ แปรผันตรงกับ ความถี่ และ ความแรง
เรื่องที่ควรรู้ก่อนทำโจทย์
1. Pย่อย จะเป็นอัตราส่วนตามอัตราส่วนโมลของแก๊สในระบบ
2. ลูกโป่งจะหยุดพอง เมื่อ ความดันภายในลูกโป่ง = ความดันบรรยากาศ
3. การทดลองหลอดของตอริเชลลี่เกิดความคลาดเคลื่อนเป็นผลมาจาก ความดันไอน้ำในอากาศ
(เคยมีผู้ต่อท่อทำการทดลองเลียนแบบที่ตึก 55 ปีของเรา)
4. เรากำจัดไอน้ำในอากาศได้โดยเอาอากาศใส่หลอดทดลองไปแช่ถังน้ำแข็ง (ไอน้ำจะกลั่นตัวลงมา)
5. วัดความดันใช้ บารอมิเตอร์/มานอร์มิเตอร์
6. สมการแก๊สจริงคือ (P+ n^2.a)(V-n.b) = nRT
V^2
โดย a และ b เป็นค่าคงตัวแวนเดอร์วาลล์ เป็นค่าประจำแก๊สแต่ละตัว โจทย์ต้องกำหนดมา
*หมายเหตุ ไม่ต้องท่องนะ แค่เห็นไว้คุ้นๆตาเผื่อมันถาม
7. การเก็บแก๊ส คือเก็บโดยวิธีแทนที่น้ำ
8. วัดปริมาตรแก๊ส ใช้หลอดฉีดยา (จะได้ปริมาตรที่ความดันบรรยากาศ)
9. ความหนาแน่นแก๊สแปรผันตรงกับ มวลโมเลกุล ความดัน และแปรผกผันกับ อุณหภูมิ
10. เวลาทำการทดลองกฏของเกย์ลูสแซ็ก ถ้าใช้น้ำเป็นตัวเลื่อนแทนลูกสูบ แล้วให้ความร้อนให้แก๊สขยายตัว
ต้องดึงให้ระดับน้ำเสมอกับนอกหลอดก่อนอ่านค่า (มิฉะนั้นจะคลาดเคลื่อนจากความดันน้ำ)
คำแนะนำ
1. สำหรับโจทย์ซับซ้อน เช่น แก๊สแพร่เข้าสู่ภาชนะอื่นและทำปฏิกิริยากับแก๊สในนั้นไปพร้อมๆกัน
ผู้ทำมีสิทธิ์แยกคิดออกเป็นสองขั้นตอน คือคิดความดันที่เปลี่ยนไปจากการแพร่ แล้วหาความดันที่เปลี่ยนไปจากการทำปฏิกิริยา หรือจะทำอีกอันก่อนก็ได้(ยังไม่เจอในแบบฝึกด้านหลัง แต่เจออ.ยกตัวอย่างในห้อง)
2. ระวังหน่วยดีๆ เรื่องแก๊สไม่ยาก แต่มักจะหลอกด้วยหน่อย หรือปริมาตรภาชนะ อ่านดีๆ ว่าต่อเข้าด้วยกัน หรือถ่ายไปภาชนะที่สองอย่างเดียว
3. ระวังเรื่องการคำนวนปริมาณสารสัมพันธ์ทั่วไปจากเทอม1 อาจต้องใช้บ้าง
ของเหลว
คุณสมบัติเบื้องต้นของของเหลว
- ปริมาตรคงตัว รูปร่างไม่คงตัว
- แพร่ได้
- ความดันส่วนมากมาจากมวลกดทับ ไม่ใช่การชนของอนุภาค
การระเหย
เกิดจากการที่โมเลกุลของของเหลวมาชนโมเลกุลที่อยู่บริเวณผิวหน้า
ทำให้โมเลกุลบริเวณผิวหน้ามีพลังงาน(จลน์)มากพอจะสลายพันธะระหว่างโมเลกุล แล้ว
วิ่งหลุดออกไป
เนื่องจากโมเลกุลที่หลุดมันเอาพลังงานไปด้วย การระเหยจึงเป็นการดูดความร้อน ทำให้สิ่งแวดล้อมเย็นขึ้น
ปัจจัยที่มีผล
- พื้นที่ผิวหน้า เยอะ->มีที่ระเหยมาก->ระเหยดี
- อุณหภูมิ สูง->พลังงานจลน์ยิ่งมาก->ระเหยดี
- ความชื้น/ความดัน สูง->กดผิวหน้าไว้->ระเหยแย่
- สมบัติเฉพาะตัว (แรงยึดเหนี่ยว) สูง->ระเหยยาก
- ความดันไอ สูง->ระเหยดี
การเดือด
คือการที่ของเหลวทั้งก้อนเปลี่ยนสถานะเป็นแก๊ส ต่างกับการระเหยตรงที่
- การเดือดเกิดทุกจุด การระเหยเกิดแค่ผิวหน้า
- การเดือดเกิดที่อุณหภูมิเดียว การระเหยเกิดได้ทุกอุณหภูมิ
ความดันไอ
คือความดันของไอของเหลวในภาชนะปิด เมื่อทำการทดลองพบว่า
ที่อุณหภูมิที่ปกติของเหลวจะเดือด ความดันไอจะมีค่าเท่ากับความดันบรรยากาศ
แรงในของเหลว
1. แรงตึงผิว
- ยิ่งของเหลวมีแรงตึงผิวมาก หยดจะยิ่งกลม
- แรงตึงผิวสัมพันธ์กับ cohesion
2. แรงเชื่อมแน่น(cohesion)
คือแรงระหว่างโมเลกุลของเหลวด้วยกันเอง
3. แรงยึดติด(adhesion)
คือแรงระหว่างโมเลกุลของเหลวกับพื้นผิวอื่น
ถ้า cohesion>adhesion
หยดจะกลม ถ้าเป็นในหลอดทดลอง จะเว้านูนขึ้น (เช่นปรอท)
ถ้า adhesion>cohesion
หยดจะแบนๆ ถ้าเป็นในหลอดทดลอง จะเว้าลง (เช่นน้ำ)
ข้อควรรู้เกี่ยวกับของเหลว
- ถ้าต้มของเหลวในภาชนะปิด ของเหลวจะไม่เดือด
- ความดันไอเพิ่มตามอุณหภูมิ และเป็นสมบัติเฉพาะตัวของแต่ละสาร
ของแข็ง
เป็นสถานนะของสสาร ที่ รูปร่างคงที่ ปริมาตรคงที่ หน่วยย่อยเรียงชิดติดกัน(packed)ทำให้หน่วยย่อยเคลื่อนที่ไม่ได้
แบ่งเป็น ของแข็งที่มีรูปผลึก
ของแข็งอสัณฐาน(ของแข็งที่ไม่มีรูปผลึก )
ของแข็งที่มีรูปผลึก
เกิดจากหน่วยย่อยๆมาแพ็ครวมกัน ซึ่งหน่วยย่อยๆอาจเป็น อะตอม หรือ โมเลกุล
ของแข็งที่ควรรู้จัก
คาร์บอน
มีหน่วยย่อยเป็น อะตอม
- เพชร
เกิดจากอะตอมสร้างแขนออกไปสี่พันธะมุม 109.5 องศา
เกิดเป็น โครงผลึกร่างตาข่าย หน้าตาแบบนี้
- จุดเดือดจุดหลอมเหลว สูงมาก
- มีความแข็งมาก (10 ตาม สเกลของโมส์)
- กราไฟต์
เกิดจากอะตอมสร้างออกไปเพียงสามพันธะ 3 แขนเท่านั้น ต่อๆกันเป็นแผ่นรูปหกเหลี่ยม
ทำให้แต่ละอะตอมมีอิเล็คตรอนอิสระ (จะไม่เห็นในรูป)
- แต่ละแผ่นยึดกันด้วยแรงลอนดอน หรืออีกชื่อ
ชื่อหนึ่งคือแรงแผ่กระจาย ซึ่งมีค่ามากขึ้นตาม ขนาดโมเลกุล (ม.ปลายอนุโลมเป็นมวลโมเลกุล)
แต่แรงลอนดอนก็ไม่แข็งแรง แกรไฟต์จึงหลุดเป็นแผ่นได้
จึงใช้ทำไส้ดินสอ สารหล่อลื่น
- เพราะมีอิเล็คตรอนอิสระ แกรไฟต์จึงนำไฟฟ้าได้ แต่กราไฟต์นำไฟฟ้าได้ในแนวแผ่นเท่านั้น(แนวสีเดียวกันในรูป)
กำมะถัน
มีหน่วยย่อยเป็น โมเลกุล S8 หน้าตาแบบนี้

และโมเลกุลจะมารวมตัวกันเป็นผลึก ได้หน้าตาออกมาสองแบบคือ
Rhombic sulfur และ Monoclinic Sulfur แบบนี้
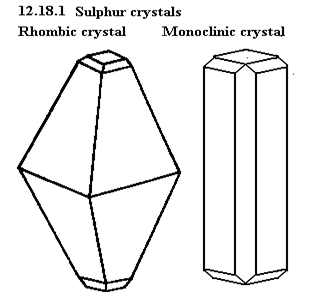
|
กำมะถันรูปเหลี่ยม (Rhombic)
|
ฟอสฟอรัส
มีหน่วยย่อย เป็นโมเลกุล P4 หน้าตาแบบนี้ (ยกเว้นฟอสฟอรัสดำ)
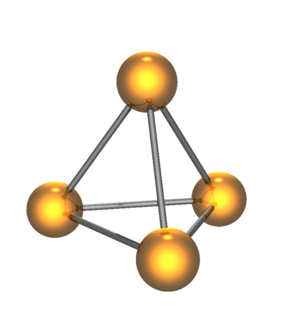
มีรูปแบบที่ต้องรู้จักอยู่สามรูปแบบ คือ
1. ฟอสฟอรัสขาว
เป็นโมเลกุลแบบในรูปหน่วยย่อยข้างบนมาอยู่ด้วยกันเฉยๆ
- มีความว่องไวต่อการเกิดปฏิกิริยามาก (วางทิ้งไว้ติดไฟขึ้นเองได้)
2. ฟอสฟอรัสแดง
คือเราเอาหน่วยย่อยของฟอสฟอรัสขาวมาวางต่อกัน
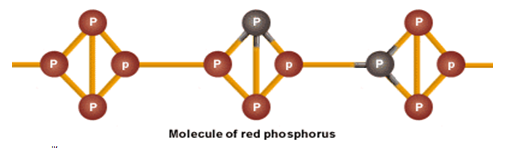
แบบนี้ ฟอสฟอรัสแดงจะว่องไวน้อยกว่าฟอสฟอรัสขาว เราจึงใช้ทำไม้ขีดไฟ
3. ฟอสฟอรัสดำ
เป็นอัญรูปที่เสถียรที่สุดของฟอสฟอรัส จะเรียงตัวเป็นแผ่นบิดๆ แล้วซ้อนกันคล้ายๆกราไฟต์
ในแผ่นเป็นโครงร่างตาข่าย
สรุปลักษณะผลึกของแข็ง
1. ผลึกโมเลกุล มีขั้ว
2. ผลึกโมเลกุล ไม่มีขั้ว -> ส่วนมากระเหิดได้
3. ผลึกโครงร่างตาข่าย -> จุดเดือดจุดหลอมเหลวสูง
การระเหิดของของแข็ง
- การระเหิดของของแข็ง เกิดจากพลังงานความร้อนที่ได้รับสลายพันธะโดยตรง ไม่ได้เกิดเฉพาะที่ผิวหน้าแบบของเหลว (เกิดทุกจุดเหมือนการเดือด)



ความคิดเห็น