คืนค่าการตั้งค่าทั้งหมด
คุณแน่ใจว่าต้องการคืนค่าการตั้งค่าทั้งหมด ?
ลำดับตอนที่ #4 : Bio ❤ Protein

Protein
โปรตีนเป็นสารชีวโมเลกุลอีกชนิดหนึ่งที่มีความสำคัญต่อสิ่งมีชีวิตโดยมาจากรากศัพท์ภาษากรีกว่า proteose ซึ่งแปลว่า “สำคัญเป็นอันดับแรก” โมเลกุลของโปรตีนประกอบไปด้วยธาตุ คาร์บอน (C) ร้อยละ 53 ออกซิเจน (O) ร้อยละ 23 ไนโตรเจน (N) ร้อยละ 16 ไฮโดรเจน (H) ร้อยละ 7 และกำมะถัน (S) ร้อยละ 1 นอกจากนี้โปรตีนบางชนิดยังมีธาตุ ฟอสฟอรัส (P) สังกะสี (Zn) และ ทองแดง (Cu) เป็นองค์ประกอบอยู่ด้วย โปรตีนเป็นองค์ประกอบที่สำคัญของสิ่งมีชีวิติโดยมีมากถึงร้อยละ 50 ของน้ำหนักแห้ง ในร่างกายคนพบว่ามีโปรตีนเป็นองค์ประกอบเกือบทุกส่วน เช่น กล้ามเนื้อ เลือด ผม เล็บ และกระดูกโปรตีนเป็นสารอินทรีย์ที่มีน้ำหนักโมเลกุลสูงมาก มีหน่วยโครงสร้างที่เล็กที่สุด คือ กรดอะมิโน ดังนั้นหากจะศึกษาโครงสร้างและสมบัติของโปรตีนจำเป็นจะต้องศึกษาโครงสร้างและสมบัติของกรดอะมิโนก่อน
Amino acid
กรดอะมิโนเป็นหน่วยโครงสร้าง (Building block) ที่เล็กที่สุดของโปรตีนโครงสร้างทางเคมีของกรดอะมิโน ประกอบด้วย 4 ส่วนคือ หมู่คาร์บอกซิล (-COOH) หมู่อะมิโน (-NH2) หมู่อาร์ (R) หรือหมู่โซ่ข้างและไฮโดรเจนอะตอม (H) โดยที่หมู่คาร์บอกซิลจะแสดงความเป็นกรด หมู่อะมิโนจะแสดงความเป็นด่างและหมู่อาร์จะแสดงถึงความแตกต่างกันของกรดอะมิโนแต่ละชนิด หมู่ต่าง ๆ เหล่านี้จะเกาะอยู่ที่แขนของคาร์บอน (C) อะตอมเดียวกัน เรียกคาร์บอนศูนย์กลางนั้นว่า แอลฟาคาร์บอนอะตอม (a - carbon atom)
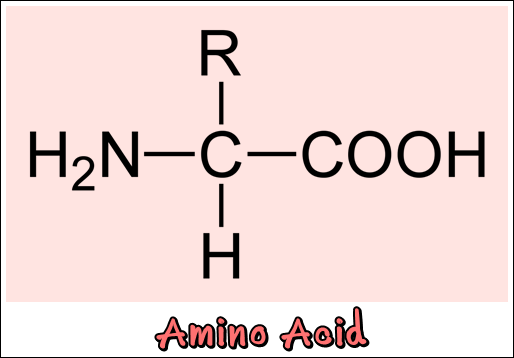
หมู่ R คือ หมู่ไฮโดรคาร์บอนซึ่งจะแตกต่างกันไป 20 แบบ ตามชนิดของกรดอะมิโนที่พบตามธรรมชาติ
โดยทั่วไปกรดอะมิโนที่เป็นส่วนประกอบของโปรตีนมีทั้งหมด 20 ชนิด และทุกชนิดเป็นกรดอะมิโนชนิดแอลฟา การเกาะกันที่หมู่ต่าง ๆ ของ A-carbon atom ทำให้กรดอะมิโนชนิดแอลฟาเกิดสเตอริโอไอโซเมอร์ แบบที่เป็นกระจกเงาหรืออีแนนนิโอเมอร์ ได้กรดอะมิโน 2 ชนิด คือ กรดอะมิโนชนิดดี (D-amino acid) และกรดอะมิโนชนิดแอล (L-amino acid) กรดอะมิโนทั้งสองชนิดพบได้ในธรรมชาติ โดยที่ L-amino acid พบมากที่สุดในธรรมชาติ และเป็นองค์ประกอบของโครงสร้างโปรตีน ส่วน D-amino acid พบได้น้อยโดยพบว่า เป็นส่วนประกอบของผนังเซลล์แบคทีเรีย
สภาพการละลายน้ำของกรดอะมิโน
กรดอะมิโนชนิดแอลฟาทุกชนิดละลายได้ในน้ำแต่ไม่ละลายในตัวทำละลายอินทรีย์ เช่น อีเทอร์ กรดอะซีโตน เมื่อละลายน้ำกรดอะมิโนทุกตัวจะแตกตัวให้ประจุ ซึ่งมีทั้งประจุบวกและประจุลบโดยที่หมู่คาร์บอกซิลจะแตกตัวให้เป็นคาร์บอกซิเลต (- COO-) ให้ประจุลบ หมู่อะมิโน (-NH2) จะแตกตัวอยู่ในรูปแอมโมเนียมอิออน (NH+3) ให้ประจุบวก การที่กรดอะมิโนมีทั้งประจุบวกและประจุลบอยู่ในโมเลกุลเดียวกันเรียกสมบัติเช่นนี้ว่า สวิทเทอร์อิออน (zwitterions) ด้วยสมบัตินี้เองทำให้กรดอะมิโนมีจุดหลอมเหลวสูงถึง 300 องศาเซลเซียส และละลายได้ในน้ำ
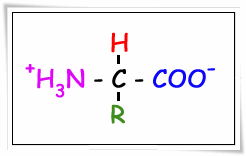
การเขียนชื่อย่อกรดอะมิโน
การเขียนชื่อย่อกรดอะมิโนทั้ง 20 ชนิด มีวิธีการเขียน 2 ระบบ คือ ระบบตัวอักษร 3 ตัว และระบบอักษรตัวเดียว
1. ระบบตัวอักษร 3 ตัว ทำโดยการเขียนตัวอักษร 3 ตัวแรกของกรดอะมิโนชนิดนั้น เช่น Alamine เขียนเป็น Ala, Proline เขียนเป็น Pro ถ้ามีตัวอักษร 3 ตัวแรกซ้ำกันจะใช้ตัวอักษรตัวสุดท้ายต่างกัน เช่น Glutamine กับ Glutamic acid จะเห็นว่าตัวอักษร 3 ตัวแรกเหมือนกันคือ Glu ดังนั้นจึงใช้ตัวอักษร 3 ตัวของ Glutamic acid เป็น Glu ส่วน Glutamine จะใช้ตัวอักษรย่อว่า Gln
2. ระบบอักษรตัวเดียว ทำโดยการเขียนตัวอักษรตัวแรกของกรดตัวนั้น เช่น Glycine จะใช้อักษร G, Histidine จะใช้อักษร H แต่ในบางครั้งอักษรตัวแรกเป็นอักษรที่ซ้ำกันจะใช้อักษรอื่นแทน เช่น Alanine ใช้อักษรย่อคือ A ส่วน Aspatic acid จะใช้อักษรย่อคือ D เป็นต้น
ตารางการเขียนชื่อย่อกรดอะมิโน 20 ชนิดที่พบในโปรตีน
กรดอะมิโน | ชื่อย่อแบบตัวอักษร 3 ตัว | ชื่อย่อแบบตัวอักษร 1 ตัว |
อะลานีน (Alanine) | Ala | A |
อาร์จีนีน (Arginine) | Arg | R |
แอสพาราจีน (Asparagine) | Asn | N |
กรดแอสพาร์ทิก (Aspartic acid) | Asp | D |
ซิสเทอีน (Cysteine) | Cys | C |
กรดกลูทามิก (Glutamic acid) | Glu | E |
กลูทามีน (Glutamine) | Gln | Q |
ไกลซีน (Glycine) | Gly | G |
ฮีสทิดีน (Histidine) | His | H |
ไอโซลิวซีน (Isoleucine) | Ile | I |
ลิวซีน (Leucine) | Leu | L |
ไลซีน (Lysine) | Lys | K |
เมไทโอนีน (Methionine) | Met | M |
ฟีนิลอะลานีน (Phenylalanine) | Phe | F |
โพรลีน (Proline) | Pro | P |
เซอรีน (Serine) | Ser | S |
ทรีโอนีน (Threonine) | Thr | T |
ทริปโทเฟน (Tryptophan) | Trp | W |
ไทโรซีน (Tyrosine) | Tyr | Y |
แวลีน (Valine) | Val | V |
การแบ่งประเภทของกรดอะมิโน
กรดอะมิโน สามารถแบ่งได้เป็น 2 กลุ่มใหญ่ ตามคุณสมบัติการมีขั้วของหมู่อาร์ (R)
1. กรดอะมิโนชนิดไม่มีขั้ว (non-polar) ไม่มีประจุ (no-charge) หรือกรดอะมิโนที่เป็นกลาง (neutral aliphatic acid) กรดอะมิโนพวกนี้หมู่อาร์ (side chain) มีลักษณะไม่ชอบน้ำ (hydrophobic) ซึ่งหมู่อาร์ส่วนใหญ่จะเป็นไฮโดรคาร์บอนที่เป็นเส้นตรงหรือวงแหวนก็ได้ ยกเว้นไกลซีน (หมู่อาร์คือไฮโดรเจนอะตอม) จัดเป็นกรดอะมิโนที่เล็กที่สุด กรดอะมิโนกลุ่มนี้มีคุณสมบัติเป็นกลาง หมู่อาร์ ไม่แตกตัวให้อิเล็กตรอนกับสารอื่น มี 9 ชนิด ได้แก่
ไกลซีน อะลานีน
แวลีน ลิวซีน
ไอโซลิวซีน เมไทโอนีน
โพรลีน ฟีนิลอะลานีน
ทริปโทเฟน
2. กรดอะมิโนพวกมีขั้ว (polar) สามารถแบ่งได้อีกเป็น 3 กลุ่มย่อยตามประจุสุทธิของหมู่อาร์
2.1 พวกที่หมู่อาร์ มีขั้ว แต่ไม่มีประจุ (no-charge)
กรดอะมิโนในกลุ่มนี้ หมู่อาร์มีขั้ว แต่ไม่มีประจุ หมู่อาร์ส่วนใหญ่จะเป็นหมู่ไฮดรอกซิล (Hydroxyl, -OH) หมู่เอไมด์ (amide, -CONH2) หมู่ไทออล (thiol) หรือหมู่ซัลฟ์ไฮดริน (sulfhydrin, -SH) หมู่ข้างต้นนี้ประกอบด้วยอะตอมที่มีอิเล็กตรอนให้สารอื่นได้ สามารถเกิดพันธะไฮโดรเจนกับน้ำ มีคุณสมบัติที่ชอบน้ำ แต่ไม่สามารถแตกตัวเป็นประจุได้ ส่วนใหญ่มีประจุเป็นศูนย์ที่ pH เป็นกลาง กรดอะมิโนกลุ่มนี้มักพบบริเวณผิวนอกของโปรตีนเพราะชอบน้ำ กรดอะมิโนกลุ่มนี้มี 6 ชนิด ได้แก่
แอสพาราจีน กลูทามีน
เซอรีน ซิสเทอีน
ไทโรซีน ทรีโอนีน
2.2 พวกที่หมู่อาร์ มีขั้ว มีประจุสุทธิเป็นลบ
กรดอะมิโนกลุ่มนี้หมู่อาร์ จะมีคาร์บอกซิล (-COOH ) เมื่ออยู่ในสารละลายที่ pH 7 จะแตกตัวให้โปรตอน (-COO-) ทำให้มีประจุสุทธิเป็นลบ มีคุณสมบัติที่ชอบน้ำ และมีคุณสมบัติเป็นกรด จึงเรียกกรดอะมิโนพวกนี้ว่า กรดอะมิโนชนิดเป็นกรด (acidic amino acid) กรดอะมิโนในกลุ่มนี้มี 2 ชนิด ได้แก่
กรดแอสพาร์ทิก และ กรดกลูทามิก
2.3 พวกที่หมู่อาร์ มีขั้วมีประจุสุทธิเป็นบวก
กรดอะมิโนกลุ่มนี้หมู่อาร์ มีหมู่เอมีนอยู่ (-NH2) เมื่ออยู่ในสารละลายที่ pH 7 จะมีคุณสมบัติในการรับโปรตอน ทำให้ประจุสุทธิในโมเลกุลเป็นบวก (-NH+3) กรดอะมิโนในกลุ่มนี้จึงมีคุณสมบัติเป็นเบส จึงเรียกกรดอะมิโนกลุ่มนี้ว่า กรดอะมิโนชนิดเบส (basidic amino acid) กรดอะมิโนในกลุ่มนี้มี 3 ชนิด ได้แก่
ไลซีน อาร์จินีน
ฮิสทิดีน
จากโครงสร้างของกรดอะมิโนทั้ง 20 ชนิด จะเห็นว่า ไกลซีน เป็นกรดอะมิโนที่เล็กที่สุด ไม่มีคาร์บอนชนิดอสมมาตร ซิสเทอีนและเมไทโอนีนมีกำมะถันเป็นองค์ประกอบอยู่ในโมเลกุล ฟีนิลอะลานีน ไทโรซีน และทริปโทเฟน เป็นกรดอะมิโนที่มีวงอะโรแมติกอยู่ในโมเลกุล ส่วนกรดอะมิโนอื่น ๆ ส่วนใหญ่หมู่อาร์จะเป็นไฮโดรคาร์บอน
การแบ่งกรดอะมิโนตามความต้องการของร่างกายแบ่งได้เป็น 2 กลุ่มใหญ่ ได้แก่
1. กรดอะมิโนจำเป็น (Essential amino acid)
เป็นกรดอะมิโนที่ร่างกายสร้างขึ้นเองไม่ได้ ต้องได้รับจากอาหารเท่านั้น กรดอะมิโนเหล่านั้นมี 10 ชนิด ได้แก่ อ าร์จินีน ฮิสทิดีน ไอโซลิวซีน ลิวซีน ไลซีน เมไทโอนีน ฟีนิลอะลานีน ทรีโอนีน ทริปโทเฟน และแวลีน แต่อย่างไรก็ตาม มีเพียง 2 ชนิดคือ ฮิสทิดีน และอาร์จินีน มีความจำเป็นเมื่อตอนเป็นเด็กเท่านั้น เมื่อเติบโตเต็มที่แล้วร่างกายสามารถสังเคราะห์เองได้
2. กรดอะมิโนไม่จำเป็น (Non- essential amino acid )
เป็นกรดอะมิโนที่ร่างกายสามารถสร้างเองได้โดยอาศัยวัตถุดิบอื่นโดยผ่านกระบวนการทรานอะมิเนชั่น (Transamination) ได้แก่
อะลานีน โพรลีน
ไกลซีน เซอรีน
ซีสเทอีน ไทโรซีน
แอสพาราจีน กลูทามีน
กรดแอสพาร์ทิก
กรดกลูทามิก
การแบ่งกรดอะมิโนตามการให้รสสามารถแบ่งได้ ดังนี้
1. กรดอะมิโนที่ให้รสหวาน ได้แก่ กรดกลูทามิก อะลานีน ไกลซีน เซอรีน และ ทรีโอนีน
2. กรดอะมิโนที่มีรสขม ได้แก่ อาร์จีนีน ฮีสติดีน ไอโซลิวซีน ลิวซีน และ ฟีนิลอะลานีน
3. กรดอะมิโนที่มีรสหวานปนขมได้แก่ โพรลีนและแวลีน
4. กรดอะมิโนที่ให้รสเปรี้ยวได้แก่ ซิสเทอีน
5. กรดอะมิโนที่ไม่มีรสได้แก่ แอสพาราจีน
กรดอะมิโนชนิดพิเศษ (Unwal amino acid)
กรดอะมิโนที่ไม่ได้เป็นส่วนประกอบในโปรตีนแต่ทำหน้าที่เป็นฮอร์โมนและมีความสำคัญต่อเมแทบอลิซึมของสัตว์เลี้ยงลูกด้วยนม เช่น Dopa ทำหน้าที่เป็นสารตัวกลางที่พบในขบวนการสังเคราะห์อดรีนาลิน Citrulline เป็น intermediate ในวัฏจักรยูเรีย เป็นต้น
Tip
กรดกลูทามิกซึ่งเป็นกรดอะมิโนที่พบในผงชูรสหรือน้ำซอสปรุงรสในรูปเกลือของโซเดียม (monosodium glutamate, MSG) เป็นผลิตภัณฑ์ที่ได้จากกระบวนการย่อยและการหมักของถั่วเหลืองหรือมันสำปะหลัง หรือกากน้ำตาล ส่วนใหญ่ใช้ประกอบอาหารเพื่อให้อาหารมีรสกลมกล่อม (umami taste) กรดกลูทามิกมีรสหวานคล้ายน้ำต้มเนื้อ นิยมใช้ในการปรุงอาหารของชาวตะวันออกไกล เนื่องจากการไม่นิยมบริโภคสัตว์ใหญ่ แต่นิยมสัตว์ขนาดเล็ก การบริโภคข้าวกับปลาเพียงอย่างเดียวนั้นมีรสชาติที่ไม่อร่อย แต่เมื่อเติมน้ำปลาหรือซอสปรุงรสที่มีกรดกลูทามิกเป็นองค์ประกอบอยู่จะช่วยให้อาหารอร่อยขึ้นและรับประทานอาหารได้มากขึ้น แต่ถ้ารับประทานในปริมาณมากจะทำให้เกิดอาการคอแห้งหิวน้ำ มีอาการวิงเวียนคลื่นไส้ เรียกอาการเช่นนี้ว่า Chinese restaurant syndrome เนื่องจากอาการดังกล่าวมักเกิดหลังจากการรับประทานอาหารจากภัตตาคารอาหารจีน
คุณสมบัติของกรดอะมิโน
1. คุณสมบัติทางกายภาพ ได้แก่
1.1 คุณสมบัติในการละลาย (solubility) กรดอะมิโนเมื่อแตกตัวจะให้สารที่มีประจุจึงละลายได้ดีในตัวทำละลายที่มีขั้ว เช่น น้ำ แอลกอฮอล์ แต่ไม่ละลายในตัวทำละลายไม่มีขั้ว เช่น เบนซีน เฮกเซน เป็นต้น
1.2 จุดหลอมเหลว (melting point) กรดอะมิโนทั่วไปมีจุดหลอมเหลวสูงมากกว่า 200 องศาเซลเซียส บางชนิดมีจุดหลอมเหลวสูงกว่า 300 องศาเซลเซียส
1.3 รส (taste) กรดอะมิโนมีทั้งที่ไม่มีรส รสขม และรสหวาน ตัวอย่างเช่น ไอโซลิวซีน ให้รสขม ไกลซีน อะลานีน แวลีน โพรลีน ทริปโทเฟน เซอรีน และ ฮีสทิดีน ให้รสหวาน เป็นต้น
1.4 คุณสมบัติการดูดกลืนแสงยูวี (UV absorption) กรดอะมิโนที่มีโครงสร้างวงแหวนในโมเลกุล เช่น ไทโรซีน ทริปโทเฟน และ ฟีนิลอะลานีน มีความสามารถในการดูดแสงอัลตราไวโอเลตมีความยาวคลื่น 280 nm คุณสมบัติข้อนี้ทำให้สามารถนำไปวิเคราะห์หาปริมาณของกรดอะมิโนหรือปริมาณโปรตีนได้ เนื่องจากโปรตีนทุกชนิดจะมี ไทโรซีน เป็นองค์ประกอบ
1.5 คุณสมบัติการหมุนแสงระนาบเดียว กรดอะมิโนทุกชนิดที่เป็นกรดอะมิโนชนิดอสมมาตร (ยกเว้น ไกลซีน) สามารถหมุนแสงโพลาไรส์ได้ ถ้าหมุนแสงไปทางขวาใช้สัญลักษณ์ d หรือ (+) ถ้าหมุนแสงไปทางซ้าย ใช้สัญลักษณ์ l หรือ (-) สารผสมที่มีรูป (+) และ (-) ในปริมาณโมลาร์เท่ากันจะไม่หมุนระนาบแสง
2. คุณสมบัติทางเคมี
2.1 สมบัติในการแตกตัว (Ionization)
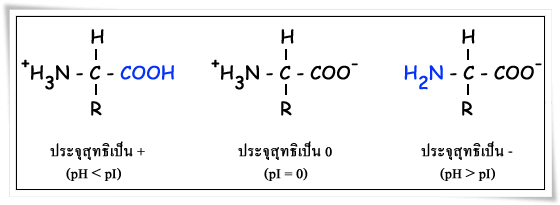
กรดอะมิโนทุกชนิดเมื่ออยู่ในสารละลายที่เป็นกลางจะมีความสามารถในการแตกตัวเป็นประจุ โดยหมู่คาร์บอกซิล (-COOH) ซึ่งแสดงความเป็นกรดอ่อนจะแตกตัวให้โปรตอน (H+) แก่หมู่อะมิโน (NH2) ซึ่งแสดงความเป็นเบสอ่อน ทำให้เกิด internal salt ได้แอมโมเนียมอิออน (-NH3+) ทำให้เกิดสภาพที่เรียกว่า สวิทเทอร์อิออน (zwitterions) ทำให้สารละลายมีคุณสมบัติเป็นไปได้ทั้งกรดและเบส เรียกสารละลายที่มีคุณสมบัติเป็นได้ทั้งกรดและเบสว่า สารแอมโพเทอริก (amphoteric compound)
กรดอะมิโนเมื่ออยู่ในสารละลายที่มีค่า pH ค่าหนึ่งซึ่งทำให้กรดอะมิโนแตกตัวหลังให้ประจุสุทธิเป็นศูนย์ เรียก pH ที่ทำให้ประจุสุทธิในโมเลกุลของโปรตีนเป็นศูนย์ว่า pI (Isoelectric point) ณ จุดที่ pH ของสารละลายเท่ากับ pI กรดอะมิโนจะมีความสามารถในการละลายต่ำสุดทำให้โปรตีนตกตะกอนได้ กรดอะมิโนอยู่ในสารละลายที่เป็นด่าง (pH > pI) การละลายของกรดอะมิโนจะสูงขึ้น เนื่องจากโปรตอนในแอมโมเนียมอิออน (-NH+3) ถูกดึงออกจาก zwitterions ทำให้มีประจุสุทธิเป็นลบ แต่ถ้ากรดอะมิโนอยู่ในสารละลายที่เป็นกรด (pH < pI) การละลายของกรดอะมิโนจะสูงขึ้น เนื่องจากคาร์บอกซิเลตอิออน (-COO- ) ของ zwitterions จะรับโปรตอนจากสารละลายทำให้มีประจุสุทธิเป็นบวก
2.2 การทำปฏิกิริยาของหมู่อะมิโน (-NH2) ไนโตรเจนในหมู่อะมิโนสามารถทำพันธะกับรีเอเจนต์ชนิดต่าง ๆ ได้ เช่น
2.2.1 การทำปฏิกิริยากับนินไฮดริน (Ninhydrin)
กรดอะมิโนสามารถทำปฏิกิริยากับสารละลายนินไฮดรินได้ผลิตภัณฑ์ คือ CO2 NH3 และ สารประกอบแอลดีไฮด์ ซึ่งนินไฮดรินที่ถูกรีดิวซ์จะทำปฏิกิริยากับ NH3 จะได้สารประกอบสีน้ำเงินม่วง (Ruheman’s blue) จะดูดกลืนแสงสูงสุดที่ความยาวคลื่น 540 nm ปฏิกิริยานี้เป็นปฏิกิริยาที่ใช้ในการทดสอบกรดอะมิโนเบื้องต้น เนื่องจากกรดอะมิโนทุกตัวจะทำปฏิกิริยากับนินไฮดรินได้สารละลายสีน้ำเงินม่วง ยกเว้น โพรลีน กับไฮดรอกซิลโพรลีน ทำปฏิกิริยากับนินไฮดรินได้สารละลายสีเหลือง จะดูดกลืนแสงสูงสุดที่ความยาวคลื่น 440 nm
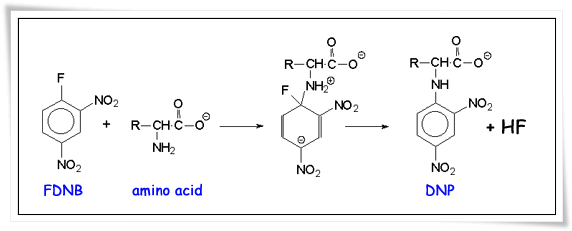
2.2.2 การทำปฏิกิริยากับ FDNB
กรดอะมิโนทุกชนิดเมื่อทำปฏิกิริยากับ FDNB (fluorodinitrobenzene) หรือ แซงเกอร์รีเอเจนต์ (sangerreagent) จะได้อนุพันธ์กรดอะมิโนไดไนโตรฟินิล (dinitrophenylated amino acid, DNP) ให้สารละลายสีเหลืองซึ่งเป็นสารประกอบที่เรืองแสงได้ วิธีนี้นิยมใช้วิเคราะห์หาลำดับของกรดอะมิโนในสายพอลิเพปไทด์และหาชนิดของกรดอะมิโนที่อยู่ปลายอะมิโน (N- terminal)
2.2.3 ทำปฏิกิริยากับแดนซิลคลอไรด์ (dansyl chloride)
กรดอะมิโนทำปฏิกิริยากับแดนซิลคลอไรด์ จะได้อนุพันธ์แดน-ซิลของกรดอะมิโนที่เรืองแสงได้ แล้วนำไปวัดการเรืองแสงด้วยฟลูออเรสเซนซ์ วิธีนี้ใช้หาชนิดของกรดอะมิโนที่อยู่ปลายอะมิโน (N- Terminal)
2.2.4 ทำปฏิกิริยากับฟีนิลไอโซไทโอไซยาเนต
เป็นวิธีการหาลำดับกรดอะมิโนที่ปลาย N เนื่องจากกรดอะมิโนสามารถทำปฏิกิริยากับสารฟีนิลไอโซไทโอไซยาเนต (phenyl isothiocyanate, PITC) หรือ เอ็ดมานรีเอเจนต์ (Edman’s reagent) ภายใต้สภาวะที่เป็นด่างอ่อน ๆ จะได้ ฟีนิลไทโอคาร์บามิล แอดดัก (phenylthiocarbamyl adduct, PTC) เมื่อเติมกรดไฮโดรฟลูโอริก (anhydrous F3CCOOH) จะได้อนุพันธ์ของไทอะโซลิโนน (thiazolinone derivative) แยกออกจากสายพอลิเพปไทด์ จากนั้นเติมสารละลายอินทรีย์เพื่อสกัดเอาอนุพันธ์ของไทอะโซลิโนนออกมา เติมกรดเพื่อเปลี่ยนรูปให้เป็นฟีนิลไทโอไฮแดนโทอิน (phenlythiohydantoin, PTH) นำสารที่ได้ไปทำเปเปอร์หรือธินเลเยอร์โครมาโทกราฟีเทียบกับสารมาตรฐาน จะสามารถหากรดอะมิโนชนิดนั้น ๆ ได้
2.3 ปฏิกิริยาหมู่คาร์บอกซิล (-COOH)
2.3.1. ทำปฏิกิริยากับแอลกอฮอล์ได้เอสเทอร์ (esterification)
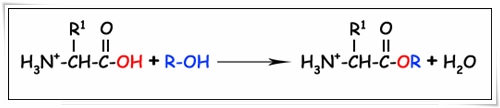
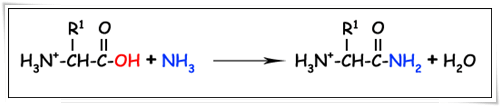
2.3.2. ทำปฏิกิริยากับแอมโมเนียได้เอไมด์ (amide formation)
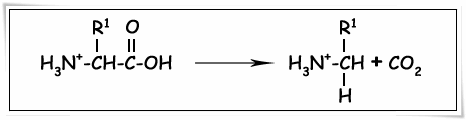
2.3.3. ทำปฏิกิริยาการสลายตัวของหมู่คาร์บอกซิลให้คาร์บอนไดออกไซด์ (decarboxylation)
2.4 ปฏิกิริยาของหมู่อาร์ ที่หมู่อาร์ ของกรดอะมิโนบางชนิดสามารถเกิดปฏิกิริยาเคมีเฉพาะตัว แสดงฤทธิ์เป็นกรด เบส หรือเป็นกลางได้แล้วแต่ชนิดของกรดอะมิโนนั้นๆ เช่น
2.4.1 หมู่อาร์ ที่มีวงอะโรมาติก (aromatic group) เป็นองค์ประกอบ เช่น ฟีนิลอะลานีน ไทโรซีน และทริปโทเฟน สามารถทดสอบด้วย Xanthoproteic reaction ได้สารละลายสีส้มแดง
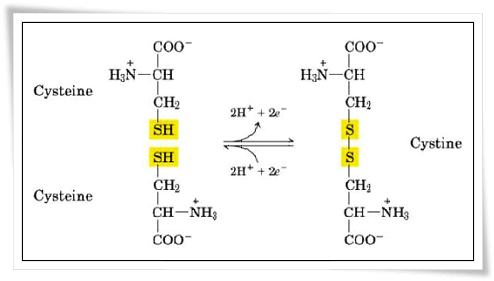
2.4.2 หมู่อาร์ ที่มีหมู่ไทออล (-SH) เป็นองค์ประกอบเช่น ซีสเทอีน สามารถทดสอบได้โดยให้ทำปฏิกิริยากับเลตแอซีเตต จะให้ตะกอนสีดำของเลตซัลไฟด์ นอกจากนี้ยังสามารถเกิดปฏิกิริยาออกซิเดชันของหมู่ไทออลในซีสเทอีน 2 โมเลกุล ได้เป็น ซิสทีน (cystine) ซึ่งหมู่ไทออลจะยึดกันด้วยพันธะไดซัลไฟด์ ทำให้โปรตีนมีโครงสร้างที่แข็งแรงขึ้น
2.5 การเกิดสารประกอบเพปไทด์
กรดอะมิโน 2 ชนิดนำมาเชื่อมกันด้วยพันธะเพปไทด์ (peptide bond) จะได้สารประกอบเพปไทด์ การเชื่อมกันของพันธะเพปไทด์จะเกิดขึ้นระหว่างหมู่คาร์บอกซิลของกรดอะมิโนตัวที่ 1 กับหมู่อะมิโนของกรดอะมิโนตัวที่ 2 โดยมีการสูญเสียน้ำออกมา 1 โมเลกุล การเชื่อมกันของกรดอะมิโน 2 ตัวด้วยพันธะเพปไทด์ได้สารประกอบที่เรียกว่า ไดเพปไทด์ (dipeptide) ถ้ากรดอะมิโน 3 ตัวเชื่อมกันด้วยพันธะเพปไทด์จะเรียกสารประกอบนั้นว่า ไทรเพปไทด์ (tripeptide) ถ้ากรดอะมิโน 10-100 ตัวเชื่อมกันด้วยพันธะเพปไทด์จะเรียก พอลิเพปไทด์ (polypeptide) ถ้ากรดอะมิโนเชื่อมกันด้วยพันธะเพปไทด์มากกว่า 100 ตัวขึ้นไปจะเรียกว่า โปรตีน
2.6 ทรานส์อะมิเนชัน (Transamination)
คือกระบวนการเคลื่อนย้ายหมู่อะมิโนของกรดอะมิโนและกรดคีโท โดยเอนไซม์ทรานส์อะมิเนสทำให้ได้กรดอะมิโนและกรดคีโทที่ต่างไปจากเดิม
2.7 ดีอะมิเนชัน (Deamination)
เป็นกระบวนการที่กรดอะมิโนเปลี่ยนเป็นกรดคีโท โดยจะเกิด 2 ขั้นตอนคือ ขั้นแรกจะเป็นการสูญเสียไฮโดรเจนไป 2 อะตอม ขั้นที่สองจะเป็นการเติมน้ำเข้าไปในโมเลกุล
อนุพันธ์ของกรดอะมิโน (Amino acid derivative)
นอกเหนือจากกรดอะมิโน 20 ชนิดแล้วยังมีกรดอะมิโนอื่น ๆ ที่ไม่ได้เป็นส่วนประกอบของโปรตีน แต่มีความสำคัญต่อโครงสร้างและหน้าที่การทำงานของโปรตีน อาจเป็นกรดอะมิโนที่ได้จากกการดัดแปลงกรดอะมิโนเดิมในสายพอลิเพปไทด์
ตารางอนุพันธ์ของกรดอะมิโน
อนุพันธ์ของกรดอะมิโน | หน้าที่/ความสำคัญ |
Y-aminobutyric (GABA), | เป็นอนุพันธ์ของไทโรซีนทำหน้าที่เป็นตัวส่งสัญญาณประสาท |
4- hydroxyproline | เป็นส่วนประกอบของโปรตีนที่พบในคอลลาเจน |
Canaline | เป็นกรดอมิโนมีพิษที่สกัดออกมาได้จากถั่ว jack bean |
b- alanine | เป็นส่วนในโครงสร้างของกรดแพนโตเธนิค |
Citrulline (2-amino-5-ureido pentanonic acid ) | เป็นสารตัวกลางที่พบในขบวนการสังเคราะห์ยูเรีย |
dihydroxyphenylalanine (DOPA) | เป็นสารตัวกลางที่พบในขบวนการสังเคราะห์อดรีนาลิน |
หน้าที่ของกรดอะมิโน
กรดอะมิโนเป็นหน่วยโครงสร้างที่เล็กที่สุดของโปรตีน ได้มาจากอาหารและร่างกายสังเคราะห์ได้เอง ร่างกายจะเก็บกรดอะมิโนไว้ใน Amino acid pool เนื้อเยื่อต่างๆ สามารถนำไปใช้ประโยชน์ได้ดังนี้
1. สังเคราะห์เป็นโปรตีนชนิดต่างๆ
2. สังเคราะห์เป็นสารต่างๆ สำหรับควบคุมเมแทบอลิซึมและควบคุมการทำงานภายในเซลล์
3. โครงสร้างคาร์บอนของกรดอะมิโนชนิดต่างๆ ถูกนำไปออกซิไดส์ให้พลังงานแก่เซลล์
Protein
โปรตีนเป็นพอลิเมอร์ของกรดอะมิโนชนิดแอลฟามาเชื่อมต่อกันเป็นสายยาวด้วยพันธะเพปไทด์ จำนวนตั้งแต่ 100-1,000 โมเลกุลจึงทำให้โปรตีนเป็นสารชีวโมเลกุลที่มีน้ำหนักโมเลกุลสูง มีโครงสร้างซับซ้อนขึ้นอยู่กับการเชื่อมต่อของกรดอะมิโนที่แตกต่างกัน ลำดับการเรียงตัวกันของกรดอะมิโนมีความสำคัญต่อการกำหนดโครงสร้างของโปรตีนแต่ละชนิด โปรตีนที่มีโครงสร้างแตกต่างกันจะมีหน้าที่ที่แตกต่างกันไปด้วย การศึกษาโปรตีนให้เข้าใจจำเป็นจะต้องศึกษาโครงสร้างของโปรตีน ประเภทของโปรตีน สมบัติของโปรตีน และประโยชน์ของโปรตีนในสิ่งมีชีวิต
โครงสร้างของโปรตีน (Protein structure)
โปรตีนมีโครงสร้างที่ซับซ้อน แบ่งออกได้หลายระดับขึ้นอยู่กับพันธะที่ทำให้เกิดโครงสร้างระดับนั้นๆ ทำให้เกิดเป็นโครงสร้าง สามมิติ ของโปรตีนที่มีความจำเพาะ หากพันธะในโครงสร้างของโปรตีนถูกทำลายจะทำให้โครงสร้างของโปรตีนสูญเสียไป ไม่สามารถทำงานได้หรือทำให้กลับคืนสู่สภาพเดิมได้ โครงสร้างของโปรตีนแบ่งเป็น 4 ระดับตามพันธะที่เกิด คือ
1. โครงสร้างระดับปฐมภูมิ (Primary structure)
เป็นโครงสร้างพื้นฐานของโปรตีนทุกชนิด ประกอบด้วยกรดอะมิโนที่มีการเรียงลำดับที่แน่นอนมาต่อกันด้วยพันธะเพปไทด์ (หรือพันธะเอไมด์) ซึ่งเป็นพันธะโคเวเลนต์ที่ไม่สามารถทำลายได้ง่าย การเชื่อมกันด้วยพันธะเพปไทด์ของกรดอะมิโนจะมีปลายด้านหนึ่งเหลืออยู่ กรดอะมิโนตัวแรกจะมีหมู่อะมิโนเหลืออยู่ที่ปลายด้านหนึ่งเรียกปลายด้านนั้นว่า กรดอะมิโนปลายเอ็น (N- Terminal amino acid) ส่วนกรดอะมิโนตัวสุดท้ายจะมีหมู่คาร์บอกซิลเหลืออยู่ที่ปลายอีกด้านหนึ่ง เรียกปลายด้านนั้นว่า กรดอะมิโนปลายซี (C-terminal amino acid) สามารถเรียกสารประกอบเพปไทด์ตามชื่อของกรดอะมิโนที่มาต่อกันได้ตามปลายของหมู่อิสระที่เหลืออยู่ ตัวอย่างเช่น กรดอะมิโน Gly-Pro-His-Phe ปลาย N คือ Glycine ปลาย C คือ Phenylalanine มีชื่อเรียกว่า Glycyl-prolyl-histidyl-phenylalanine
คุณสมบัติของโปรตีนแต่ละชนิดนั้นขึ้นอยู่กับหมู่แทนที่ของกรดอะมิโนกับปริมาณหรือลำดับของหมู่แทนที่ของกรดอะมิโน ซึ่งเป็นส่วนที่มีอิทธิพลต่อการเกิดโครงสร้างสามมิติในระดับถัดไป โครงสร้างระดับปฐมภูมินี้จะบอกลำดับของกรดอะมิโนที่มาเรียงต่อกันด้วยพันธะเพปไทด์ ลำดับของกรดอะมิโนในโครงสร้างระดับปฐมภูมินั้นถูกกำหนดด้วยจีนในสิ่งมีชีวิตแต่ละชนิด และถ้าลำดับของกรดอะมิโนมีความผิดปกติไป จะทำให้โครงสร้างสามมิติของโปรตีนผิดปกติไปด้วย ทำให้บทบาททางชีวภาพของโปรตีนเปลี่ยนแปลงตามไปด้วย
2. โครงสร้างระดับทุติยภูมิ (Secondary structure)
โครงสร้างระดับทุติยภูมิเป็นการเรียงตัวกันตามแนวแกนเดียวของสายพอลิเพปไทด์ เกิดการบิด (twist) หรือพับ (fold) เนื่องจากพันธะไฮโดรเจนที่เกิดจากสายพอลิเพปไทด์สายเดียวกันหรือคนละสายก็ได้ Linus Pauling และ Robert Corey ศึกษาโครงสร้างสามมิติของโปรตีน โดยอาศัยเทคนิคที่เรียกว่า X-ray Crystallography พบว่า เพปไทด์ชอบที่จะมีการจัดเรียงตัวให้มีโครงสร้างสามมิติ โดยใช้พันธะไฮโดรเจนซึ่งเป็นพันธะที่เกิดระหว่างกรดอะมิโนที่อยู่ใกล้กันเกิดแรงยึดเหนี่ยวระหว่างกัน ทำให้ได้โครงสร้างสามมิติของโปรตีนที่มีความเสถียร เรียกโครงสร้างแบบนี้ว่า โครงสร้างสามมิติระดับทุติยภูมิ โครงสร้างทุติยภูมิที่พบมากมี 2 ชนิดคือ เกลียวแอลฟา (a-helix) และ แผ่นพลีตบีต้า (b-pleated sheet)
2.1 เกลียวแอลฟา หรือ แอลฟาเฮลิกซ์ (a-helix) เป็นโครงสร้างที่มีลักษณะเป็นแท่ง เกิดจากการหดตัวกันของสายพอลิเพปไทด์เป็นเกลียวหรือเฮลิกซ์ได้ทั้งแบบเวียนขวาและเวียนซ้าย ในธรรมชาติมักพบโครงสร้างที่เป็นเกลียวเวียนขวา โครงสร้างที่เป็นเกลียวนั้นเกิดจากการสร้างพันธะไฮโดรเจนระหว่างอะตอมของไฮโดรเจน (H) ที่อยู่ในหมู่อะมิโน (-NH2) ของกรดอะมิโนตัวหนึ่งกับออกซิเจน (O) ที่อยู่ในหมู่คาร์บอกซิล (-COOH) ของกรดอะมิโน ที่อยู่ถัดไป 4 ตำแหน่งบนสายพอลิเพปไทด์เดียวกัน ทำให้เกิดการบิดเป็นเกลียว โดยเกลียวแต่ละเกลียวจะมีจำนวนกรดอะมิโน 3.6 หน่วยต่อรอบ ระยะห่างระหว่างกรดอะมิโนแต่ละตัวเท่ากับ 1.5 อังสตรอม (0A) มีระยะห่างระหว่างเกลียว 0.54 นาโนเมตร (5.4 อังสตรอม ) และหมู่แขนงข้างของกรดอะมิโนจะชี้ออกด้านข้าง ปี ค.ศ.1950 ได้มีการศึกษาโครงสร้างแบบเฮลิกซ์ครั้งแรกในโปรตีนที่ชื่อ เคราติน (keratin) ซึ่งเป็นโปรตีนที่พบในเส้นผม
2.2 แผ่นพลีตบีต้าหรือ บีต้าชีต (b-Sheet) เป็นโครงสร้างอีกแบบที่ต่างจากเกลียวแอลฟาตรงที่พันธะไฮโดรเจนในโครงสร้างเกิดระหว่างสายพอลิเพปไทด์ มีลักษณะเป็นแผ่นจีบพับไปมาคล้ายกระเบื้องมุงหลังคา แผ่นพลีตบีต้ามี 2 ชนิด คือ แบบขนาน (parallel) และแบบสวนทาง (antiparallel) แผ่นพลีตบีต้าแบบขนาน เกิดจากการทำพันธะระหว่างหมู่คาร์บอกซิลของกรดอะมิโนสายหนึ่งทำพันธะไฮโดรเจนกับไฮโดรเจนอะตอมของหมู่อะมิโนของอีกสายหนึ่ง โดยสายพอลิเพปไทด์จะเรียงตัวในทิศทางเดียวกัน แผ่นพลีตบีต้าแบบขนานจะพบมากในโปรตีนที่เป็นทรงกลม แผ่นพลีตบีต้าแบบสวนทาง เกิดจากการทำพันธะระหว่างหมู่คาร์บอกซิลกับไฮโดรเจนอะตอมเช่นเดียวกับแบบขนานแต่มีทิศทางของสายพอลิเพปไทด์สวนทางกัน แผ่นพลีตบีต้าแบบสวนทางกันจะพบมากในโปรตีนเส้นใย เช่น โปรตีนไฟโบรอินในเส้นไหม ในธรรมชาติจะพบโครงสร้างของแผ่นพลีตบีต้าแบบสวนทางกันมากกว่าแบบขนาน เนื่องจากแบบสวนทางกันมีความแข็งแรงกว่าแบบขนาน
เกลียวแอลฟาหรือแผ่นพลีตบีต้าอาจเชื่อมต่อกันด้วยห่วง (Loop) ที่มีขนาดและรูปร่างที่แตกต่างกันทำให้เกิดโครงสร้างทุติยภูมิที่ยิ่งยวด (super secondary structure) หรือเรียกอีกชื่อหนึ่งว่า โมทีฟ (motif)
3. โครงสร้างระดับตติยภูมิ (Tertiary structure)
เป็นโครงสร้างของโปรตีนที่แสดงถึงรูปร่าง (conformation) ที่แท้จริงของโปรตีน เป็นโครงสร้างสามมิติของโปรตีนที่มีทั้งความ กว้าง ยาว และหนา โดยโปรตีนจะมีการม้วนตัว (protein folding) ขดไปมา การม้วนตัวของโปรตีนเกิดจากพันธะต่าง ๆ เช่น พันธะไดซัลไฟด์ พันธะไฮโดรเจน พันธะไฮโดรโฟบิก แรงยึดระหว่างประจุ แรงแวนเดอร์วาลล์ เป็นต้น การม้วนตัวของโปรตีนทำให้เกิดโครงสร้างตติยภูมิที่เหมาะสมในการทำงานในสภาวะของร่างกาย ตัวอย่างของโปรตีนที่มีโครงสร้างเช่นนี้คือ ไมโอโกลบิน เป็นโปรตีนที่มีฮีม พบในเซลล์กล้ามเนื้อและเนื้อเยื่ออื่น ๆ ทำหน้าที่เป็นตัวรับออกซิเจนมาจากเฮโมโกลบินในเลือดมาเก็บไว้
4. โครงสร้างระดับจตุรภูมิ (Quaternary structure)
เป็นโครงสร้างของโปรตีนที่ประกอบด้วยหน่วยย่อยของสายพอลิเพปไทด์มากกว่า 1 สายขึ้นไป มารวมกันโดยอาศัยแรงยึดเหนี่ยวอย่างอ่อน เช่น เฮโมโกลบินมี 4 หน่วยย่อย คือ แอลฟา 2 หน่วยและบีต้า 2 หน่วย รวมตัวกันโดยอาศัยแรงแวนเดอร์วาล การที่โปรตีนมีโครงสร้างจตุรภูมินั้นก็เพื่อทำให้ไม่ต้องสร้างสายพอลิเพปไทด์ขนาดใหญ่มาก ๆ และถ้าหากมีจุดบกพร่องตรงหน่วยย่อยใดก็สามารถแก้ไขเฉพาะหน่วยย่อยนั้นได้
ประเภทของโปรตีน
1. แบ่งตามโครงสร้าง สามารถจำแนกได้เป็น 3 กลุ่มใหญ่ ๆ คือ โปรตีนอย่างง่าย โปรตีนประกอบ และโปรตีนอนุพันธ์ ดังนี้
1.1 โปรตีนอย่างง่าย (Simple proteins) คือโปรตีนที่ประกอบด้วยกรดอะมิโนทั้งหมด ไม่มีสารประกอบอื่นรวมอยู่ในโมเลกุลด้วย แบ่งได้เป็น 2 ประเภทตามโครงรูป คือ
1.1.1 โปรตีนเส้นใย (Fibrous protein) เป็นโปรตีนที่มีโครงรูปของสายพอลิเพปไทด์เป็นเส้นยาว ไม่ละลายน้ำแต่ละลายในตัวทำละลายอินทรีย์ ทำหน้าที่เป็นโครงสร้างของร่างกายเนื่องจากมีความแข็งแรงและยืดหยุ่นสูง เช่น คอลลาเจน เคราติน อีลาสติน ไฟโบรอิน เป็นต้น
1.1.2 โปรตีนก้อนกลม (Globular protein) เป็นโปรตีนที่มีโครงรูปของสายพอลิเพปไทด์ขดไปมาอัดแน่นเป็นทรงกลม ละลายน้ำได้ ทำหน้าที่เกี่ยวข้องกับกระบวนการต่าง ๆ ภายในเซลล์ เช่น เป็นเอนไซม์ เป็นฮอร์โมน ตัวอย่างของโปรตีนก้อนกลมได้แก่ อัลบูมิน โกลบูมิน ไมโอโกลบิน และไซโทโครมซี เป็นต้น
1.2 โปรตีนประกอบหรือโปรตีนคอนจูเกต (Conjugated protein) คือ โปรตีนที่เมื่อย่อยสลายแล้วจะได้กรดอะมิโนและมีสารอื่น ๆ ที่ไม่ใช่โปรตีนรวมอยู่ด้วย สารประกอบที่ไม่ใช่โปรตีนเรียกว่าหมู่ prosthetic ตัวอย่างเช่น
คอนจูเกตโปรตีน | หมู่ prosthetic + โปรตีน | ตัวอย่าง |
ไกลโคโปรตีน | คาร์โบไฮเดรต + โปรตีน | มิวซินในน้ำลาย |
ไลโพโปรตีน | ลิปิด+ โปรตีน | พลาสมาโปรตีน |
นิวคลีโอโปรตีน | กรดนิวคลีอิก+ โปรตีน | โครโมโซม |
เมทัลโลโปรตีน | โลหะ+ โปรตีน | เอนไซม์แลกติกดีไฮโดรจีเนส์ |
ฟอสโฟโปรตีน | ฟอสเฟต+ โปรตีน | เคซีนในน้ำนม |
1.3 โปรตีนอนุพันธ์ (Derived protein) เป็นโปรตีนที่ได้จากการย่อยสลายโปรตีนใน 2 กลุ่มแรก ด้วยเอนไซม์หรือปฏิกิริยาเคมี เช่น เจลาตินเป็นโปรตีนอนุพันธ์ที่ได้จากการย่อยสลายคอลลาเจนโดยการต้มด้วยกรด เป็นต้น
2. แบ่งตามหน้าที่ โปรตีนทำหน้าที่มากมายในสิ่งมีชีวิต สามารถจัดกลุ่มโปรตีนตามหน้าที่ได้ดังนี้
2.1 เอนไซม์ (enzyme) เป็นโปรตีนที่ทำหน้าที่เร่งปฏิกิริยาเคมีในสิ่งมีชีวิต ตัวอย่างเช่น เอนไซม์เพปซิน (pepsin) ที่ใช้ในการย่อยโปรตีนในกระเพาะอาหาร เอนไซม์ดีเอนเอพอลิเมอเรส (DNA polymerase) ใช้ในการสังเคราะห์ดีเอ็นเอ
2.2 โปรตีนโครงสร้าง (structure protein) ทำหน้าที่เป็นโครงสร้างให้กับเซลล์และเนื้อเยื่อ ตัวอย่างเช่น คอลลาเจน (collagen)และอีลาสติน (elastin) เป็นโปรตีนที่เป็นองค์ประกอบทั่วไปภายนอกเซลล์และในช่องว่างระหว่างเซลล์ โปรตีนแอลฟาเคราติน (a-keratin) เป็นโปรตีนสำคัญที่พบในผมและเขาสัตว์ มีหน้าที่ในการสร้างความแข็งแรงให้กับเซลล์ผิว (epithelial cells)
2.3 โปรตีนขนส่ง (transport protein) เป็นโปรตีนที่ทำหน้าที่ขนส่งโมเลกุลขนาดเล็กหรืออิออน ตัวอย่างเช่น ซีรัมอัลบูมิน (serum alblumin) เป็นโปรตีนในกระแสเลือดที่ใช้ในการขนส่งลิพิด เฮโมโกลบิน (hemoglobin) เป็นโปรตีนที่ใช้ในการขนส่ง แบคเทอริโอโรดอปซิน (bacteriorhodopsin) เป็นโปรตีนที่ช่วยในการปั๊มโปรตอน (H+) ออกจากเซลล์แบคทีเรียเมื่อถูกกระตุ้นด้วยแสง
2.4 โปรตีนขับเคลื่อน (motor protein) ทำหน้าที่ช่วยในการเคลื่อนไหวภายในเซลล์และเนื้อเยื่อ ตัวอย่างเช่นโปรตีนไมโอซิน (myosin protein) ในเซลล์กล้ามเนื้อสัตว์ที่ช่วยทำให้เกิดการเคลื่อนไหว โปรตีนไดเนอิน (dynein prorein) ช่วยทำให้ซิเลียของพวกยูคาริโอตและแฟลกเจลาโบกไปมา
2.5 โปรตีนสะสม (storage protein) ทำหน้าที่เก็บสะสมโมเลกุลขนาดเล็กและอิออน ตัวอย่างเช่น การสะสมเหล็กในตับต้องอาศัยโปรตีนเฟอริติน (feritin) โปรตีนอัลบูมินในไข่ขาว (ovalbumin protein) เป็นแหล่งของกรดอะมิโนสำหรับให้ตัวอ่อนใช้ในการพัฒนาไปเป็นตัวเต็มวัย เคซีน (casine) เป็นโปรตีนในน้ำนมที่เป็นแหล่งของกรดอะมิโนสำหรับตัวอ่อนของสัตว์เลี้ยงลูกด้วยนม
2.6 โปรตีนส่งสัญญาณ (signaling protein) ทำหน้าที่ในการนำสัญญาณจากเซลล์หนึ่งไปยังเซลล์อีกเซลล์หนึ่ง ส่วนใหญ่เป็นฮอร์โมน ตัวอย่างเช่น อินซูลิน (insulin) เป็นฮอร์โมนที่ใช้ในการควบคุมเมแทบอลิซึมของกลูโคสในกระแสเลือด
2.7 โปรตีนตัวรับ (receptor protein) ทำหน้าที่เป็นตัวรับส่งสัญญาณไปบริเวณที่ตอบสนองต่อสัญญาณนั้น ๆ ในเซลล์ ตัวอย่างเช่น โรดอปซิน (rhodopsin) ที่อยู่ในบริเวณเรตินาใช้เป็นตัวตอบสนองต่อแสง อินซูลินรีเซปเตอร์ (insulin receptor) เป็นตัวช่วยให้เซลล์ตับมีการตอบสนองกับฮอร์โมนอินซูลิน
2.8 โปรตีนที่ควบคุมการแสดงออกของจีน (gene regulatory protein) หน้าที่เกี่ยวข้องกับแสดงออกของจีน ตัวอย่างเช่น lactose repressor protein ในแบคทีเรีย เป็นโปรตีนที่เกี่ยวข้องกับการย่อยสลายแลกโทส
2.9 โปรตีนป้องกัน (protective protein) ทำหน้าที่ป้องกันสิ่งแปลกปลอมจากภายนอกเซลล์ ตัวอย่างเช่น อิมมูโนโกลบูลินในเลือด
2.10 โปรตีนที่เป็นพิษ (toxin protein) เป็นโปรตีนที่เป็นพิษต่อร่างกาย เช่น พิษของงู พิษจากเชื้ออหิวาต์
2.11 โปรตีนที่ทำหน้าที่พิเศษ (special purpose protein) ทำหน้าที่หลากหลายแตกต่างกันไป เช่น antifreeze protein เป็นโปรตีนที่ช่วยป้องกันการแข็งตัวของเลือดปลาที่อยู่ในแถบขั้วโลก green fluorescent protein (GFP) เป็นโปรตีนที่เรืองแสงได้พบในแมงกะพรุน glue protein เป็นโปรตีนที่พบในหอยแมลงภู่และสัตว์น้ำบางชนิดจะหลั่งออกมาทำให้สามารถเกาะอยู่กับหินได้อย่างเหนียวแน่น
3. แบ่งตามการละลาย ได้เป็น
3.1 โปรตีนที่ละลายได้ในน้ำ ได้แก่โปรตีนอัลบูมิน (albumin) เมื่อถูกความร้อนจะจับตัวเป็นก้อน เช่น อัลบูมินจากไข่ขาว อัลบูมินจากซีรัม เป็นต้น
3.2 โปรตีนที่ไม่ละลายน้ำแต่ละลายในเกลือเจือจาง ได้แก่โปรตีนโกลบูลิน (globulin) เมื่ออยู่ในสารละลายกรดและด่างจะจับตัวเป็นก้อน เช่น โกลบูลินในไข่แดง
3.3 โปรตีนที่ละลายได้ในน้ำแต่ไม่ละลายในแอมโมเนียมไฮดรอกไซด์ เช่น โปรตีนฮีสโตน (histone) เมื่อถูกความร้อนจะไม่จับตัวเป็นก้อน
สมบัติของโปรตีน
1. คุณสมบัติทางกายภาพ
1.1 กลิ่นและรส โปรตีนบริสุทธิ์จะไม่มีรสและกลิ่น เมื่อได้รับความร้อนสูงจะเปลี่ยนเป็นสีดำและเหม็นไหม้
1.2 การละลาย (solubility) ปกติโปรตีนทั่วไปไม่ละลายน้ำ แต่มีโปรตีนบางชนิดละลายน้ำได้ขึ้นอยู่กับปริมาณหมู่ฟังก์ชันที่เป็นโพลาร์ ถ้ามีหมู่ฟังก์ชันที่เป็นโพลาร์มากจะละลายน้ำได้ดี นอกจากนี้การละลายน้ำของโปรตีนยังขึ้นอยู่กับปัจจัยต่าง ๆ อีกเช่น
1.2.1 pH ถ้าปรับ pH ของสารละลายโปรตีนให้มีประจุสุทธิเป็น 0 โปรตีนจะละลายได้น้อยและจะตกตะกอนลงมา
1.2.2 อุณหภูมิ ถ้าอุณหภูมิสูงขึ้นโปรตีนจะละลายน้ำได้ดีขึ้น
1.2.3 การเติมเกลือ ถ้าเติมเกลือเล็กน้อยโปรตีนจะละลายน้ำได้ดีขึ้น เรียกวิธีนี้ว่า ซอลติ้งอิน (salting in) แต่ถ้าเติมเกลือจำนวนมากจะทำให้โปรตีนละลายได้น้อยลงและตกตะกอนลงมาวิธีนี้เรียก ซอลติ้งเอาท์ (salting out)
1.3 การดูดกลืนแสง โปรตีนที่มีกรดอะมิโนทริปโทเฟน ไทโรซิน และฟีนิลอะลานีน สามารถดูดกลืนแสงอัลตราไวโอเลตที่ความยาวคลื่น 280 nm
1.4 คุณสมบัติความเป็นกรด-เบส โปรตีนประกอบด้วยกรดอะมิโนมาเชื่อมต่อกันเป็นสายยาว ที่ปลายทั้งสองข้างของโปรตีนจะมีหมู่คาร์บอกซิลและหมู่อะมิโนที่เป็นอิสระ มีหมู่อาร์ที่เป็นโซ่ข้างเป็นจำนวนมาก ทำให้โปรตีนมีคุณสมบัติความเป็นกรดและเบสได้ตามคุณสมบัติของกรดอะมิโนที่เป็นองค์ประกอบ
2. คุณสมบัติทางเคมี
2.1 ปฏิกิริยานินไฮดริน (Ninhydrin reaction) เป็นปฏิกิริยาที่ใช้ทดสอบกรดอะมิโนชนิดแอลฟาที่เป็นองค์ประกอบของโปรตีนโดยทำปฏิกิริยากับสารละลายนินไฮดรินที่อุณหภูมิสูง ๆ จะได้สารประกอบแอลดีไฮด์ CO2 NH3 และให้สารละลายสีน้ำเงินม่วง ยกเว้นโพรลีนและไฮดรอกซิลพอลินจะได้สารสีเหลือง
2.2 ปฏิกิริยาไบยูเร็ต (Biuret reaction) เป็นปฏิกิริยาที่ใช้ทดสอบสารประกอบที่มี
พันธะเพปไทด์ตั้งแต่ 2 แห่งขึ้นไป โดยนำมาทำปฏิกิริยากับสารละลายคอปเปอร์ซัลเฟต (CuSO4) ในสารละลายด่างจะให้ผลเป็นสีม่วงจนถึงสีชมพูตามขนาดโมเลกุล การทดสอบด้วยไบยูเร็ตจึงเป็นปฏิกิริยาที่ใช้ทดสอบโปรตีนทั่วไป
2.3 ปฏิกิริยาแซนโทโพรเตอิก (Xanthoproteic reaction) ปฏิกิริยานี้ใช้ทดสอบโปรตีนที่มีกรดอะมิโนที่เป็นวงแหวนเบนซีนอยู่ในโมเลกุล คือ ไทโรซีน และทริปโทเฟน โดยเติมกรดไนตริกลงในสารละลายโปรตีนจะได้สารละลายสีเหลือง ปฏิกิริยานี้นิยมนำมาใช้ตรวจหาโปรตีนอัลบูมินในปัสสาวะของผู้ป่วยโรคไต
การเสียสภาพธรรมชาติของโปรตีน (Denaturation)
การสูญเสียสภาพธรรมชาติของโปรตีน หมายถึงการเปลี่ยนแปลงใด ๆ ก็ตามที่ไปรบกวนโครงสร้างสามมิติของโปรตีน (โครงสร้างทุติยภูมิ ตติยภูมิและจตุรภูมิ) ทำให้โครงสร้างสามมิติเกิดการเปลี่ยนแปลงแต่ไม่ถึงขั้นทำลายพันธะเพปไทด์ในโครงสร้างปฐมภูมิ มีผลทำให้คุณสมบัติและหน้าที่ทางชีวภาพของโปรตีนเปลี่ยนไป สารที่ทำให้โปรตีนสูญเสียสภาพธรรมชาติเรียกว่า Denaturing agent ได้แก่ กรด ด่าง เกลือของโลหะ เป็นต้น การทำให้โปรตีนสูญเสียสภาพธรรมชาติสามารถทำได้ 2 วิธี
1. วิธีทางฟิสิกส์ โดยการให้ความร้อน ความเย็น ความดันสูง การฉายรังสีเอ็กซ์ และการโดนรังสีอัลตราไวโอเลต สิ่งเหล่านี้จะไปทำลายพันธะ hydrogen และพันธะ hydrophobic ที่ไม่แข็งแรง ทำให้โปรตีนเสียสภาพเกิดการตกตะกอน ตัวอย่างเช่น การต้มไข่หรือทอดไข่ ความร้อนจะทำให้โปรตีนอัลบูมินเปลี่ยนสภาพจากของเหลวใสกลายเป็นก้อนสีขาว เป็นต้น
2. วิธีทางเคมี โดยการเติม กรดเข้มข้น ด่างเข้มข้น ตัวทำละลายอินทรีย์ (แอลกอฮอล์) เกลือของโลหะหนัก (Ag+ Pb2+ และ Hg2+) ยูเรียเข้มข้น 6 โมลาร์ หรือ อัลคาลอยด์รีเอเจนต์ (กรด picric และกรด tannic) สารเหล่านี้จะไปทำลายโครงสร้างของโปรตีน ทำให้โปรตีนเสียสภาพธรรมชาติเป็นกรดที่ไร้ระเบียบและตกตะกอนลงมา
การคืนสู่สภาพของโปรตีน (Renaturation)
ปรตีนที่สูญเสียสภาพธรรมชาติอาจมีการกลับคืนสู่สภาพธรรมชาติได้เมื่อโครงสร้างของโปรตีนเกิดการเปลี่ยนแปลงไปเพียงเล็กน้อย เช่น เอนไซม์ RNase เป็นโปรตีนที่ทำหน้าที่ย่อยสลาย RNA ให้มีขนาดเล็กลง เมื่อเติมยูเรียเข้มข้น 8 โมลาร์ผสมกับ 2- เมอร์แคบโทเอทานอลลงไปจะทำให้เอนไซม์ RNase เสียสภาพธรรมชาติไม่สามารถย่อยสลาย RNA ได้ แต่ถ้าไดอะไลส์เอาสารเคมีดังกล่าวออก เอนไซม์ RNase จะทำงานได้ดังเดิม แต่ก็มีโปรตีนบางชนิดเมื่อสูญเสียสภาพธรรมชาติแล้วไม่สามารถกลับคืนสู่สภาพเดิมได้อีก เช่น โปรตีนในไข่ขาวเมื่อต้มให้สุกแล้วไม่สามารถกลับไปสู่สภาพเดิมได้
โปรตีนที่ควรรู้จัก
1. เคราติน (keratin)
เป็นโปรตีนเส้นใยที่พบมากในสัตว์ที่มีกระดูกสันหลังทุกชนิด เป็น ส่วนประกอบของ ผม ขน เขา และเล็บ แบ่งออกเป็น 2 ชนิด คือ แอลฟาเคราตินซึ่งพบในสัตว์เลี้ยงลูกด้วยนม และบีต้าเคราตินซึ่งพบในนกและสัตว์เลื้อยคลาน โครงสร้างของแอลฟาเคราตินที่พบในเส้นผมและเขาสัตว์จะเป็นเกลียวเวียนขวาประกอบด้วยเกลียวแอลฟา 3 เส้น มาม้วนพันกันเป็น protofibril และ protofibril จำนวน 11 หน่วยจะมารวมตัวเป็นมัดเล็ก ๆ เรียก microfibril ( มี 2 หน่วยอยู่ตรงกลาง อีก 9 หน่วยล้อมรอบ) ในเส้นผมจะมี microfibril เป็นจำนวนมากฝังอยู่ใน matrix protein ซึ่งมีปริมาณกรดอะมิโนซิสเทอีนสูงยึดกันด้วยพันธะไดซัลไฟด์ ในเขาและเขี้ยวของสัตว์จะมีลักษณะเช่นเดียวกับในเส้นผมแต่มีพันธะไดซัลไฟด์ใน matrix protein มากกว่าจึงแข็งแรงกว่าไม่สามารถยืดได้เหมือนเส้นผม
2. คอลลาเจน (collagen)
เป็นโปรตีนเส้นใยที่เป็นส่วนประกอบของเนื้อเยื่อเกี่ยวพัน เช่น กระดูก ฟัน กระดูกอ่อน และ เอ็น โครงสร้างประกอบด้วยหน่วยย่อยของ tropocollagen มีลักษณะเป็นเกลียวเวียนซ้ายของสายพอลิเพปไทด์ 3 เกลียวมาม้วนกันเป็นเกลียวใหญ่เวียนขวา ประกอบด้วย ไกลซีน 35% อะลานีน 11% โพรลีน 12% และไฮดรอกซิลโพรลีน 11% ถ้านำคอลลาเจนมาต้มในสารละลายกรดเป็นเวลานานจะได้เจลลาติน
3. ไฟโบรอิน (fibroin)
เป็นโปรตีนเส้นใยที่พบใน เส้นไหม เส้นใยแมงมุม ขนนก เกล็ดของสัตว์เลื้อยคลาน โครงสร้างทุติยภูมิของไฟโบรอินจะเป็นแผ่นพับบีต้าแบบสวนขนาน (antiparallel b plate sheet) ประกอบด้วยกรดอะมิโน 6 หน่วยเรียงซ้ำ ๆ กัน คือ (ไกลซีน- เซอรีน-ไกลซีน-อะลานีน-ไกลซีน-อะลานีน)n ทำให้มีคุณสมบัติเหนียว ยืดได้น้อย
4. ไมโอโกลบิน (myoglobin)
เป็นโปรตีนก้อนกลมที่มีขนาดเล็ก พบในเซลล์กล้ามเนื้อ มีหน้าที่จับกับออกซิเจน เพื่อเก็บสะสมและขนส่งไปยังไมโทคอนเดรียเพื่อใช้ในปฏิกิริยาออกซิเดชันของสารอาหาร ไมโอโกลบิน มีหนึ่งโซ่พอลิเพปไทด์ประกอบด้วยกรดอะมิโน 153 หน่วย มีฮีม (heme) เป็นหมู่พรอสเธติก หมู่ฮีมนี้ทำให้ไมโอโกลบินมีสีน้ำตาลเข้ม
5. เฮโมโกลบิน (hemoglobin)
เป็นโปรตีนก้อนกลม พบในเม็ดเลือดแดงทำหน้าที่ขนส่งออกซิเจน โครงสร้างประกอบด้วย 4 โซ่พอลิเพปไทด์ และมีหมู่ฮีม 4 หมู่ ซึ่งเป็นหมู่พรอสเธติกที่มี Fe2+ เป็นองค์ประกอบ โซ่พอลิเพปไทด์ 4 สายจะประกอบด้วยโซ่พอลิเพปไทด์ 2 สายที่เป็นชนิด a (แต่ละสายมีกรดอะมิโน 141 หน่วย) และอีก 2 สายเป็นชนิด b (แต่ละสายมีกรดอะมิโน 146 หน่วย)
ความสำคัญของโปรตีน
ในเซลล์ทุกชนิดจะมีโปรตีนเป็นองค์ประกอบประมาณ 2 ใน 3 ของน้ำหนักทั้งหมดของเซลล์ โปรตีนเป็นสารประกอบที่มีความสำคัญมากต่อร่างกายของมนุษย์และสัตว์ โปรตีนมีหน้าที่เกี่ยวข้องกับสร้างและซ่อมแซมเนื้อเยื่อต่าง ๆ ของร่างกาย นอกจากนี้ยังมีหน้าที่เป็นโครงสร้างของเนื้อเยื่อของสัตว์ เกี่ยวข้องกับระบบการป้องกันอันตรายให้แก่ร่างกาย ทำหน้าที่เป็นตัวเร่งปฏิกิริยาต่าง ๆ ภายในร่างกาย เกี่ยวข้องกับการขนส่งออกซิเจน เป็นต้น ถ้าร่างกายขาดโปรตีนจะส่งผลทำให้ร่างกายไม่แข็งแรง ขาดภูมิคุ้มกัน การทำงานของกล้ามเนื้อไม่ปกติ โครงสร้างของผิวหนังไม่แข็งแรง เป็นต้น
สรุป
โปรตีนเป็นพอลิเมอร์ของกรดอะมิโนชนิดแอลฟา มาเชื่อมต่อกันเป็นสายยาวด้วยพันธะเพปไทด์ จำนวนเป็น 100-1,000 โมเลกุล โครงสร้างของกรดอะมิโนประกอบด้วยคาร์บอนอะตอมเป็นอะตอมกลาง มีหมู่อะมิโน (-NH2) หมู่คาร์บอกซิล (-COOH) ไฮโดรเจนอะตอม (H) และหมู่โซ่ข้างเคียง (หมู่อาร์) มายึดเกาะที่แขนทั้ง 4 ข้างของคาร์บอนอะตอม กรดอะมิโนที่เป็นส่วนประกอบของโปรตีนมี 20 ชนิด แต่ละชนิดจะแตกต่างกันที่หมู่อาร์ สามารถแบ่งกรดอะมิโนได้เป็น 2 กลุ่มใหญ่ ๆ ตามคุณสมบัติการมีขั้วของหมู่อาร์ คือ กรดอะมิโนที่มีขั้วและกรดอะมิโนไม่มีขั้ว กรดอะมิโนละลายได้ดีในตัวทำละลายอินทรีย์ เมื่ออยู่สารละลายจะแตกตัวเป็นประจุทำให้เกิดสภาพที่เรียกว่า สวิทเทอร์อิออน กรดอะมิโนมีจุดหลอมเหลวสูงมาก บางชนิดให้รสหวาน บางชนิดให้รสขม บางชนิดไม่มีรส กรดอะมิโนที่มีโครงสร้างวงแหวนในโมเลกุลมีความสามารถในการดูดแสงอัลตราไวโอเลตมีความยาวคลื่น 280 nm กรดอะมิโนทุกชนิด (ยกเว้น ไกลซีน) มีคุณสมบัติการหมุนแสงระนาบเดียว สารประกอบเพปไทด์เกิดจากกรดอะมิโน 2 ชนิดมาเชื่อมต่อกันด้วยพันธะเพปไทด์ สารประกอบเพปไทด์ที่มีกรดอะมิโนมาเชื่อมต่อกันมากกว่า 100 ตัวขึ้นไปจะเรียกว่า โปรตีน การเรียงลำดับของกรดอะมิโนในโปรตีนมีความสำคัญต่อโครงสร้างของโปรตีน โครงสร้างของโปรตีน มี 4 ระดับ คือ โครงสร้างระดับปฐมภูมิ เป็นโครงสร้างพื้นฐานของโปรตีนทุกชนิด ประกอบด้วยกรดอะมิโนที่มีการเรียงลำดับที่แน่นอนมาต่อกันด้วยพันธะเพปไทด์ เป็นสายยาว โครงสร้างระดับทุติยภูมิ เกิดจากสายพอลิเพปไทด์มี การบิด หรือพับ เป็นเกลียวแอลฟา หรือ แผ่นพลีต โครงสร้างระดับตติยภูมิ เป็นโครงสร้างของโปรตีนที่มีทั้ง กว้าง ยาว และหนา โดยโปรตีนจะมีการม้วนตัวขดไปมา โครงสร้างระดับจตุรภูมิ เป็นโครงสร้างของโปรตีนที่ประกอบด้วยหน่วยย่อยของสายพอลิเพปไทด์มากกว่า 1 สายขึ้นไป มารวมกันโดยอาศัยแรงยึดเหนี่ยวอย่างอ่อน โครงสร้างของโปรตีนที่แตกต่างกันทำให้โปรตีนมีหน้าที่ที่แตกต่างกันไป โปรตีนแบ่งออกเป็น 3 กลุ่มใหญ่ ๆ ตามโครงสร้าง คือ โปรตีนอย่างง่าย เป็นโปรตีนที่ประกอบด้วยกรดอะมิโนทั้งหมด ไม่มีสารประกอบอื่นๆ รวมอยู่ในโมเลกุลด้วย โปรตีนประกอบหรือโปรตีนคอนจูเกต เป็นโปรตีนที่ย่อยสลายแล้วจะได้กรดอะมิโนและมีสารอื่นๆ ที่ไม่ใช่โปรตีนรวมอยู่ โปรตีนอนุพันธ์เป็นโปรตีนที่ได้จากการย่อยสลายโปรตีนใน 2 กลุ่มแรก ด้วยเอนไซม์หรือปฏิกิริยาเคมี โปรตีนบริสุทธิ์จะไม่มีรสและกลิ่น ไม่ละลายน้ำแต่มีโปรตีนบางชนิดละลายน้ำได้ การละลายน้ำของโปรตีนขึ้นอยู่กับ pH อุณหภูมิ และ การเติมเกลือ โปรตีนที่มีกรดอะมิโนทริปโทเฟน ไทโรซิน และฟีนิลอะลานีน สามารถดูดกลืนแสงอัลตราไวโอเลตที่ความยาวคลื่น 280 nm โปรตีนมีคุณสมบัติความเป็นกรดและเบสได้ตามคุณสมบัติของกรดอะมิโนที่เป็นองค์ประกอบ โปรตีนถูกทำให้เสียสภาพได้โดย ความร้อน ความเย็น ความดัน รังสี กรด ด่าง และ เกลือของโลหะ หน้าที่ของโปรตีนในสิ่งมีชีวิตมีมายมายหลายอย่าง เช่น ทำหน้าที่เป็นเอนไซม์ควบคุมการทำงานต่าง ๆ ภายในเซลล์ บางชนิดเป็นโครงสร้างของเซลล์และเนื้อเยื่อ บางชนิดทำหน้าที่ขนส่งโมเลกุลขนาดเล็ก บางชนิดช่วยในการเคลื่อนไหวภายในเซลล์ บางชนิดทำหน้าที่เก็บสะสมโมเลกุลขนาดเล็ก บางชนิดทำหน้าที่เป็นฮอร์โมน บางชนิดทำหน้าที่เกี่ยวข้องกับแสดงออกของจีน บางชนิดทำหน้าที่ป้องกันสิ่งแปลกปลอมจากภายนอกเซลล์ และบางชนิดเป็นโปรตีนที่เป็นพิษต่อร่างกาย จากที่กล่าวมาจะเห็นว่าโปรตีนมีความสำคัญต่อสิ่งมีชีวิตเป็นอย่างมาก ถ้าร่างกายขาดโปรตีนหรือได้รับโปรตีนไม่เพียงพอต่อความต้องการของร่างกาย อาจส่งผลต่อการทำงานต่าง ๆ ภายในร่างกายทำให้เกิดความเจ็บป่วยหรือรุนแรงถึงขั้นเสียชีวิตได้
อ้างอิง : ead.univ-angers.fr/.../1AcidAmine.htm
www.chem.ucalgary.ca/.../Ch27/ch27-3.html
instruct.uwo.ca/chemistry/223b-98/a.htm
http://www.vuw.ac.nz/staff/alan_clark/teaching/courses/221/sequencing/sld017.htm
http://courses.cm.utexas.edu/archive/Spring2002/CH339K/Robertus/overheads-1/ch5_edman.jpg
courses.cm.utexas.edu/.../Lecture-Ch3-1.html
http://www.colorado.edu/kines/Class/IPHY3430-200/image/figure14i.jpg
home.comcast.net/.../P/PrimaryStructure.html
student.ccbcmd.edu/.../proteins/fg4b.html
library.tedankara.k12.tr/.../z211.gif
http://fig.cox.miami.edu/~cmallery/150/chemistry/hemoglobin.jpg
http://www.piercenet.com/media/PDetectBiuretF6.gif
http://albumen.stanford.edu/library/c20/messier1991a-d.gif
http://www.the-piedpiper.co.uk/graphics1/keratin.jpg
http://home.earthlink.net/~dayvdanls/Collagen.GIF
http://www.nd.edu/~aseriann/silk.gif

FARRY' 25


ความคิดเห็น