
ผู้เข้าชมรวม
81
ผู้เข้าชมเดือนนี้
0
ผู้เข้าชมรวม
81
ข้อมูลเบื้องต้นของเรื่องนี้
ในสารละลายกรดหรือเบสจะมีทั้ง H3O+ และ OH– อยู่ในปริมาณที่แตกต่างกัน การบอกความเป็นกรด เป็นเบสของสารละลายโดยใช้ความเข้มข้นของ H3O+ หรือ OH– มักเกิดความผิดพลาดได้ง่ายเพราะสารละลายมักมีความเข้มข้นของ H3O+ หรือ OH– น้อยดังนั้นในปี ค.ศ. 1909 นักเคมีชาวสวีเดนชื่อ ซอเรสซัน (Sorensen) ได้เสนอให้บอกความเป็นกรด-เบสของสารละลายในรูปมาตราส่วน pH ย่อมาจากภาษาฝรั่งเศสว่า puissance d,hydrogine แปลว่า กำลังของไฮโดรเจน (power of hydrogen) โดยกำหนดว่า

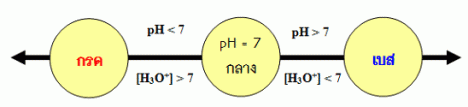
ค่า pH ที่ใช้ระบุความเป็นกรดหรือเบสของสารละลาย สรุปได้ดังนี้ สารละลายกรด มี [H3O+] มากกว่า 1.0 x 10-7 mol/dm3 ดังนั้น pH<7.00 สารละลายที่เป็นกลาง มี [H3O+] เท่ากับ 1.0 x 10-7 mol/dm3 ดังนั้น pH = 7.00 สารละลายเบส มี [H3O+] น้อยกว่า 1.0 x 10-7 mol/dm3 ดังนั้น pH>7.00
นอกจากนี้สามารถบอกความเป็นกรด-เบสของสารละลายในรูปความเข้มข้นของ OH– ก็ได้ โดยค่า pOHค่า pOH ใช้บอกความความเป็นกรด-เบสของสารละลายเจือจางได้เช่นเดียวกับค่า pH ซึ่งค่า pOH จะขึ้นอยู่กับความเข้มข้นของ OH– โดยกำหนดความสัมพันธ์ดังนี้

ตัวอย่างการคำนวณค่า pOH สารละลาย NaOH เข้มข้น 0.01 โมลต่อลูกบาศก์เซนติเมตร มี pH เท่าใด วิธีทำ NaOH (aq) ————-> Na+ (aq) + OH– (aq) 0.01 mol/dm3 0.01 mol/dm3 = 1 x 10-2 mol/dm3 pOH = -log[OH–] = -log 1×10-2 mol/dm3 = 2log10 – log1 pOH = 2

ในสารละลายที่เป็นกลางซึ่งมี [OH–] = 1.0 x 10-7 mol/dm3 จะมี pOH = 7 ความสัมพันธ์ระหว่าง pH กับ pOH [H3O+][ OH–] = 1.0 x 10-14 log[H3O+][ OH–] = log1.0 x 10-14 log[H3O+] + log[OH–] = log1.0 – 14 log10 – log[H3O+] – log[OH–] = 14 log10
มาตราส่วน pH (pH scale) ใช้บอกความเป็นกรด-เบสของสารละลาย
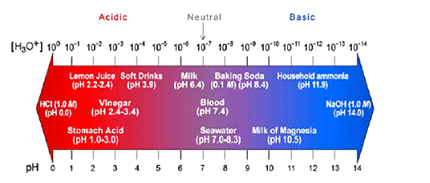
ตารางแสดง สเกล pH ของสารละลายที่มีความเข้มข้นต่างๆ กัน

วิธีวัด pH ของสารละลายวัดได้ 2 วิธี ดังนี้
1. วิธีเปรียบเทียบสี วิธีนี้เป็นการวัด pH โดยประมาณ (มีความถูกต้อง 0.5 หน่วย pH) ซึ่งทำได้โดยเติมอินดิเคเตอร์ที่เหมาะสมลงไปในสารละลายที่ต้องการวัด pH แล้วเปรียบเทียบกับสารละลาย ทำได้โดยเติมอินดิเคเตอร์ที่เหมาะสมลงไปในสารละลายที่ต้องการวัด pH แล้วเปรียบเทียบสีกับสารละลายบัฟเฟอร์ที่ทราบค่า pH แน่นอน ซึ่งได้เติมอินดิเคเตอร์ชนิดเดียวกันไปแล้ว หรือใช้กระดาษชุบอินดิเคเตอร์ (กระดาษ pH) จุ่มลงไปแล้วเปรียบเทียบกับสีมาตรฐาน
2. วิธีวัดความต่างศักย์ วิธีนี้วัด pH ได้อย่างละเอียด (มีความถูกต้อง 0.01 หน่วย pH) โดยการใช้เครื่องมือที่เรียกว่า พีเอชมิเตอร์ ซึ่งวัด pH ของสารละลายได้โดยการวัดความต่างศักย์ระหว่างขั้วไฟฟ้า 2 ขั้ว
สรุปสูตรการหาค่า pH ของสารละลาย

ความรู้เพิ่มเติม

เนื้อเรื่อง
คืนค่าการตั้งค่าทั้งหมด
คุณแน่ใจว่าต้องการคืนค่าการตั้งค่าทั้งหมด ?
สวัสี่ะ ไ้บไปแล้วนะะ ับเนื้อหาเี่ยวับ pH อรและเบส หวัว่าะไ้วามรู้ไปไม่มา็น้อย และถ้าผิพลาประารใออภัย้วยนะะ <333
ผลงานอื่นๆ ของ tacream ดูทั้งหมด
ผลงานอื่นๆ ของ tacream
คำนิยม Top
ยังไม่มีคำนิยมของเรื่องนี้
คำนิยมล่าสุด
เขียนคำนิยมยังไม่มีคำนิยมของเรื่องนี้

ความคิดเห็น