|
|
ปฏิกิริยาเคมีคือ
ขบวนการที่สารตั้งต้นเปลี่ยนไปเป็นผลิตภัณฑ์ ในระหว่างการเกิดปฏิกิริยาเคมี ปริมาณของสารตั้งต้นย่อมลดลง ยิ่งเวลาผ่านไป ปริมาณของสารตั้งต้นก็จะยิ่งเหลือน้อยลง และปริมาณของผลิตภัณฑ์ก็จะเพิ่มมากขึ้น
| |
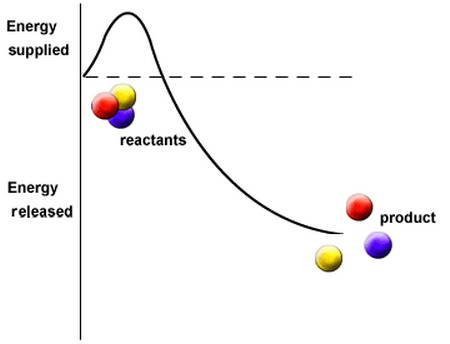
ปฏิกิริยาเคมี มี 2 ประเภท คือ
1. ปฏิกิริยาคายพลังงาน (Exergonic reaction) หมายถึง ปฏิกิริยาที่เกิดขึ้นแล้วจะปล่อยพลังงานออกมามากกว่า พลังงานกระตุ้นที่ใส่เข้าไป
2. ปฏิกิริยาดูดพลังงาน (Endergonic reaction) หมายถึง ปฏิกิริยาที่เกิดขึ้นแล้วจะปล่อยพลังงานออกมาน้อยกว่า พลังงานกระตุ้นที่ใส่เข้าไป
| |
|
|
ทฤษฎีที่อธิบายเกี่ยวกับการเกิดปฏิกิริยาเคมี
Collision theory ( ทฤษฎี การชนกัน) ทฤษฎีนี้กล่าวว่า ปฏิกิริยาเกิดจากโมเลกุลของก๊าซวิ่งชนกัน และมีการถ่ายเทพลังงานให้กันละกัน โมเลกุลที่ไปชนโมเลกุลอื่นจะมีพลังงานต่ำลง ส่วนโมเลกุลที่ถูกชนจะมีพลังงานสูงขึ้น
โมเลกุลที่เกิดปฏิกิริยา ได้ขึ้นอยู่กับ
1. โมเลกุลวิ่งชนกันแล้วมีพลังงานสูงอย่างน้อยเท่ากับค่า Ea (พลังงานกระตุ้น หรือพลังงานก่อกัมมันต์)
2. ทิศทางการชนกัน ต้องชนกันในทิศทางที่เหมาะสม จึงจะเกิดปฏิกิริยา | |
|
|
ปัจจัยที่มีผลต่อปฏิกิริยาเคมี
1. ธรรมชาติของสารตั้งต้น :
สารตั้งต้นบางชนิดทำปฏิกิริยาได้เร็วแต่บางชนิดทำปฏิกิริยาได้ช้า เช่น แผ่นโลหะทองแดง หรือแผ่นโลหะเงินจะทำปฏิกิริยากับออกซิเจนได้ช้ามาก แม้ว่าจะใช้เปลวไฟช่วยก็ไม่สามารถทำให้ปฏิกิริยาเกิดเร็วได้ ส่วนแผ่นโลหะแมกนีเซียมสามารถติดไฟได้เร็วมาก หรือฟอสฟอรัสขาวสามารถติดไฟได้เลยในอากาศ เป็นต้น
2. ความเข้มข้นของสารตั้งต้น :
สารที่มีความเข้มข้นมากจะเกิดปฏิกิริยาได้เร็วกว่าสารที่มีความเข้มข้นน้อย การเพิ่มปริมาตรโดยมีความเข้มข้นเท่าเดิมการเกิดปฏิกิริยาก็ยังคเท่าเดิม
3. พื้นที่ผิวของสารตั้งตัน :
การเพิ่มพื้นที่ผิวจะทำให้ปฏิกิริยาเกิดขึ้นได้เร็ว แต่จะมีผลต่อปฏิกิริยาเนื้อผสมเท่านั้นการเพิ่ม พ.ท. ผิวก็คือการเพิ่มความถี่ในการชนกันนั้นเอง
4. อุณหภูมิ :
การเพิ่ม อุณหภูมิ เป็นการเพิ่มพลังงานจลน์ให้แก่อนุภาค ทำให้อนุภาคเคลื่อนที่เร็วขึ้น จึงเพิ่มโอกาสการชนกัน
5. ตัวเร่ง และตัวหน่วง
ปฏิกิริยา มันจะไปลด / เพิ่ม Eaของปฏิกิริยา :ตัวเร่งปฏิกิริยา(catalyst)เป็นสารที่ช่วยเร่งให้ปฏิกิริยาเกิดได้เร็วขึ้น ตัวหน่วงปฏิกิริยา(Inhibitor)เป็นสารที่เมื่อเติมลงไปในปฏิกิริยาแล้วมีผลทำให้ เกิดปฏิกิริยาได้ช้าลง หรือหยุดยั้งปฏิกิริยาได้อย่างสิ้นเชิง | |
ขอขอบคุณ ข้อมูลที่มีประโยชน์จาก เว็บไซต์ Kmutt Library
เพื่อร่วมกันสร้างสังคมแห่งการเรียนรู้บนโลกอินเตอร์เน็ต
| |
ข้อความที่โพสจะต้องไม่น้อยกว่า {{min_t_comment}} ตัวอักษรและไม่เกิน {{max_t_comment}} ตัวอักษร
กรอกชื่อด้วยนะ
_________
กรอกข้อมูลในช่องต่อไปนี้ไม่ครบ
หรือข้อมูลผิดพลาดครับ :
_____________________________
ช่วยกรอกอีกครั้งนะครับ
กรุณากรอกรหัสความปลอดภัย


ความคิดเห็น